浓H2SO4很少离解(dissociation),几乎不导电。H2SO4在水溶液中受溶剂H2O的作用分两级离解,第一级
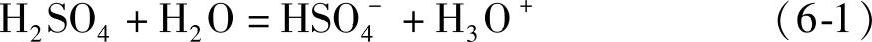
也可以简单地写成

第一级离解常数K1为
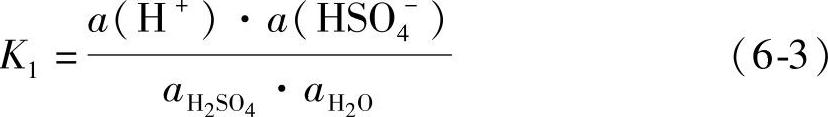
式中,a(H+)、a(HSO4-)、aH2SO4和aH2O分别是H+、HSO4-、H2SO4和H2O的活度(参看第七章第三节)。
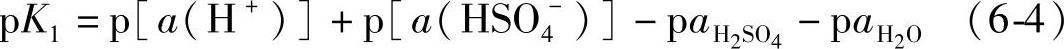
H2SO4的水溶液是强酸,K1的值约为1000,可以认为是第一级完全离解。H2SO4几乎全部以离子形式存在于水溶液中。
H2SO4水溶液的第二级离解
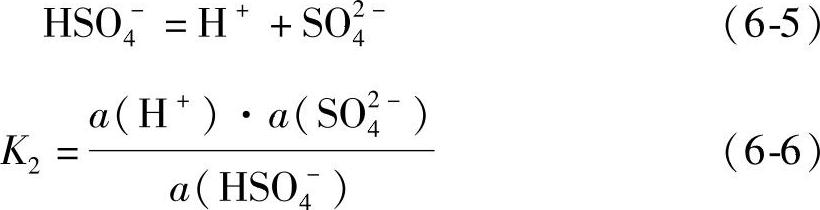
式中,a(SO2-4)是SO2-4离子的活度。
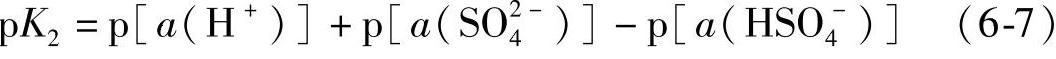
不同的作者给出的K2测定值稍有不同,在0.0102~0.0120之间,pK2的值在1.98~1.92之间[3,4]。
可以认为H2SO4溶液的第二级离解很少,仅有约1%数量级的HSO4-离子离解为H+和SO2-4离子。实际测定的H2SO4溶液中几种离子和H2SO4分子所占质量份额列在表6-6[4]。
表6-6 H2SO4溶液中H2SO4的离解
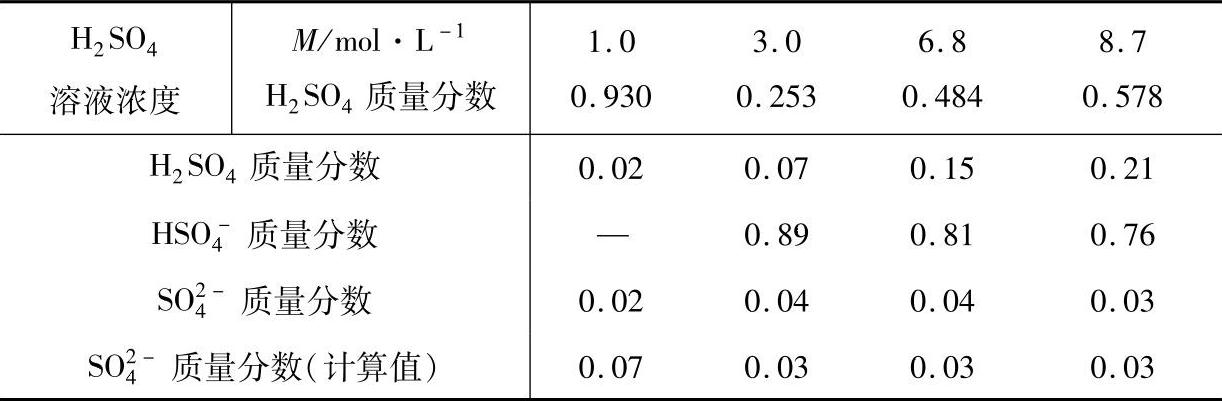
可以看到,H2SO4溶液浓度大于3mol·L-1(25.3%)时,溶液中不离解的H2SO4分子所占份额随着浓度的增大而增大。作为铅酸蓄电池电解液的H2SO4溶液并非浓度大就好。H2SO4溶液的离解度和电导率,是选取蓄电池电解液浓度的重要依据。
铅酸蓄电池以硫酸溶液为电解质溶液(电解液)。电解质溶液在蓄电池中与电子导体(第一类导体)形成界面,构成电极,在液相导电,形成蓄电池内部的电流回路;而且硫酸溶液的各组分(HSO4-、H+、H2O)还参加电极反应,和正极的PbO2、负极的海绵状金属Pb一样,都是活性物质。和电子导体相反,一般情况下可以认为硫酸溶液的电导随着温度的上升而升高。
配制蓄电池生产过程中所用以及蓄电池用的硫酸溶液,必须采用纯净的H2SO4和H2O,其最低要求是符合蓄电池用硫酸和蓄电池用水的有关技术标准。
干式荷电蓄电池(dry charged battery)产量大,应用广泛。虽然生产厂家不给蓄电池注液出厂,但有关问题亦应关注。由用户或蓄电池零售部门在安装使用前注液的干式荷电蓄电池注液后有时还需要补充电。一般说,注液的H2SO4溶液浓度应稍低于蓄电池完全充电时要求的浓度。如果要求值为38.0%(25℃时密度1.282kg·L-1),则注液浓度可以选择35%~36%,经补充电后达到38.0%。
干式荷电蓄电池的极板中含有一定量的PbSO4,不论是正极板或者负极板都如此。如果槽化成(tank formation)完成后出槽的正、负极板不经水洗或仅仅是简单的水洗即进入干燥工序,极板中的PbSO4的含量会更大些,因为极板活性物质的孔率大,接近50%,能吸收化成槽中的稀H2SO4溶液。在干燥过程中,水会很快挥发,而H2SO4却留在极板中与极板中的PbO作用生成PbSO4
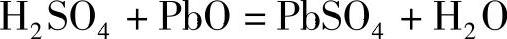
这些PbSO4在蓄电池注液充电完成后会生成相同摩尔数的H2SO4(充电不完全,生成的H2SO4略少些)
在正极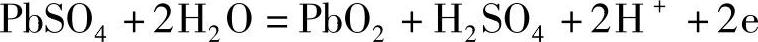
在负极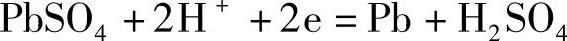
最好是定量分析正、负极板中PbSO4的含量,通过计算和实验确定干式荷电蓄电池注液的浓度和注液量。例如一种汽车起动用干式荷电蓄电池的单体蓄电池中极群组的正、负极板共13片,单体蓄电池的注液量为500mL。化成出槽后,如果不经水洗,每片极板可吸收化成电解液(浓度约为9%,25℃时密度约为1.06kg·L-1)约16mL。结果是单体蓄电池极板中含有H2SO4约20g。如果注液浓度为36.0%(25℃时密度为1.265kg·L-1),注液量为500mL,则补充电完成后电解液浓度会达到38.0%(25℃时密度为1.282kg·L-1)。
关于H2SO4溶液中添加剂的实验研究几乎没有停止过。各种硫酸盐如硫酸锂(Li2SO4)、硫酸钠(Na2SO4)、硫酸亚锡(SnSO4)都曾被采用过。有作者认为,只要在电解液中加入10-6(百万分之一)级的硫酸钴(CoSO4),就能够大幅度提高阀控密封式铅酸蓄电池的循环寿命。钴离子能使腐蚀膜密度增大,增强PbO2与板栅的结合[6]。
湿荷电铅酸蓄电池(drained and charged lead acid battery)是一种极板处于荷电状态,带有少量电解液,大部分电解液被吸入极板和隔板中的铅酸蓄电池。通常是在蓄电池内化成后,部分排放出电解液,经防氧化处理和密封而制成的,使用前要注入电解液。防氧化处理工序常用Na2SO4溶液,排放时不可能把Na2SO4全部排出,这种蓄电池的电解液必然含有Na2SO4。(https://www.xing528.com)
磷酸是正磷酸(H3PO4)、焦磷酸(H4P2O7)、聚磷酸、偏磷酸[(HPO3)n]的总称。(正)磷酸作为蓄电池电解液的得失是有争议的。
无论如何,添加剂的研究目的在于局部改进蓄电池的某些性能,就整体而言,并未影响到硫酸溶液作为铅酸蓄电池电解质的主导作用。
有作者提出提高H2SO4在水溶液中二级离解常数,增加电解液中H+或SO42-离子浓度,增加电解液的渗透性(permeabili-ty)和电极反应速率的途径。其具体方法是在H2SO4溶液中加入多种有机物和无机物:
(1)功能高分子聚丙烯酰胺(polyacrylamide,PAM)(M≥3×106);
(2)主链结构为(—C—Si—O—)n的硅氧烷(siloxanes)聚合衍生物;
(3)稠环(fused-ring)醌苯和乙二胺四乙酸(EDTA)10-4~5×10-4;
(4)果酸、磷酸、硼酸。
这种电解液可以明显提高VRLA的容量,改善VRLA的低温放电的电压和容量,在-30℃和-40℃时尤为显著[5]。
聚丙烯酰胺是白色粉末或半透明珠粒和薄片,密度为1.30kg·L-1(23℃),玻璃化温度为153℃,软化温度为210℃,溶于水,具有减阻、粘接、稳定胶体、阻垢等功能,能导入其他基团而在诸多工业部门用作分散剂、添加剂和化学助剂。其结构式如图6-4所示。
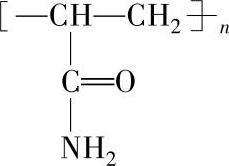
图6-4 聚丙烯酰胺的结构式
提出来的各种各样的有机物添加剂还有不少。事实上,负极添加剂如木质素及其衍生物、腐殖酸、松香、1-羟基-2-萘甲酸等,在蓄电池注液及其后的运行过程中,必然会有一部分或其中的某些组分或多或少地溶解而进入电解液,实际上形成了电解液的有机添加剂。
木质素在硫酸溶液中溶解度很小,但其磺酸盐的溶解度是可观的。腐殖酸中的胡敏酸(humilic acid)、胡敏素(humin)虽然在硫酸溶液中溶解度很小,但腐殖酸中的另外一些组分如富啡酸(fulvic acid)又称黄腐酸在硫酸溶液中的溶解度并不小,尤其是在蓄电池放电后硫酸浓度颇低的情况下更是如此。
板栅合金中的某些金属也会在蓄电池注液及以后的运行中不断以金属离子的形式进入电解液。
20世纪80年代阀控密封式铅酸蓄电池获得重大进展之前,铅酸蓄电池几乎都是富液蓄电池(flooded cell;flooded battery)。这种蓄电池的极板完全浸没在电解液中。液面高出极板的电解液很容易溢出,不仅腐蚀端子,也腐蚀相邻物件。把H2SO4吸收在硅胶胶体的微孔中是探索解决溢酸问题的一种方法。从20世纪前期就有胶体电解质铅酸蓄电池,此项研究至今取得不小进展。
通常是以硅溶胶(silica sol,SiO2·nH2O)又称胶体二氧化硅(colloidal silica)或二氧化硅溶胶(colloidal silica sol)作为H2SO4溶液的凝固剂(coagulating agent;coagulant),使两者混合后凝固。溶胶被破坏,SiO2粒子互相聚集而形成凝胶并不再恢复原状。
由水玻璃即硅酸钠(sodium silicate,Na2O·nH2O)稀溶液经过滤,阳离子交换,阴离子交换,调节pH值,再经浓缩即可制得硅溶胶。硅溶胶也可以用硅粉与氢氧化钠溶液反应,过滤制得。
简单地用水玻璃的稀溶液和H2SO4溶液混合注入蓄电池而形成胶体电解质的方法,由于蓄电池性能差和其他不易克服的缺陷,近二三十年来已被摒弃。
以另一种形式存在的二氧化硅叫白炭黑(white carbon black;silica SiO4·nH2O),是白色无定形粉状物,质轻而松散,溶于碱金属的氢氧化物(如NaOH、KOH、LiOH)溶液。虽然白炭黑与炭黑不是一种物质(后者是单质碳),但其宏观结构与炭黑类似,粒子呈球状,单粒子之间以面相互接触,形成链状连接结构(二次结构)。链枝结构又以氢键(hydrogen bond)互相作用,形成一团团的聚集体。其原始粒子极为细微,质轻,分散度好,可用来制备硅溶胶电解质。可以把白炭黑溶于碱溶液,过滤并稀释,加入浓度较大的H2SO4浓液制成铅酸蓄电池用的胶体电解质。白炭黑分为沉淀法和气相法两种。气相法产品常被采用。尤其是触变性(thixotropy)胶体电解质多采用气相法二氧化硅。
凝固后不再能恢复原状的胶体电解质的缺陷,如干涸、开裂,难以维护等是明显的。之后又提出采用具有触变性的凝胶作为H2SO4溶液的载体。什么是触变性呢?即呈现具有一定柔顺性的半固体状态的凝胶,也有些凝胶的网状结构不稳定,可以因机械力如摇动或振动等变为有较大流动性的溶液状态(稀化),外力解除,静置后又恢复胶凝状态重新稠化。这一特性即触变性。
采用吸收于触变性硅胶(thixotropic silica sol)的H2SO4溶液作为电解质的铅酸蓄电池,称为触变硅胶(电解质)蓄电池(thixotropic silica acid battery)。德国SÖnnenschein公司生产的Dryfit型系列小型铅酸蓄电池即此种蓄电池[7]。
H2SO4溶液作为铅酸蓄电池的电解质,不论是分散在硅胶或触变性硅胶空隙中,只是存在的物理状态在形式上的不同,其参与的正、负极电极反应及电池反应和在液相中的导电作用并无改变。
胶体电解质铅酸蓄电池在解决铅酸蓄电池溢酸问题方面和阀控密封式铅酸蓄电池的思路可以说是异曲同工。后者是改善板栅合金材料,紧装配,迷宫式液孔塞,微孔吸液式超细纤维隔板,并设计成贫液蓄电池(starved electrolyte battery);前者是电解液本身胶凝。
胶体电解质铅酸蓄电池对于减轻电解液的分层(stratification of electrolyte)有一定作用。分层现象是指蓄电池在放电过程中,由于极板不同部位的电流密度不同导致不同部位(特别是不同高度)电解液的浓度不同。极板较高的大型铅酸蓄电池,放电时上部电流密度较大,放电反应消耗的H2SO4较多,反应生成的H2O也较多,下部电流密度较小,消耗的H2SO4与生成的H2O也较少。经多次循环或较长时间运行,导致下部电解液浓度较大,可能会引起极板硫酸盐化。特大型如额定容量接近10000A·h的铅酸蓄电池,设计安装有电解液循环装置,驱动电解液的循环流动。
胶体电解质铅酸蓄电池运行一段时间后,电解质也会产生“通道”,充电时正极产生的氧气由此扩散至负极,与负极产生的游离金属铅作用生成PbO。PbO与H2SO4作用生成PbSO4和H2O,氧又回到液相,减少了气体的逸出,和阀控密封式铅酸蓄电池的氧循环作用相同。
胶体电解质铅酸蓄电池有显著的不足之处。首先是蓄电池内阻增大,充电时充电电压稍高,放电时工作电压稍低。内阻增大的原因,一是正、负极之间存在有固相二氧化硅或硅酸盐;二是电解质的相对黏度(relative viscosity)较H2SO4溶液大,导电离子在其中运动所受阻滞较大。近来不少研究者制备的胶体电解质已降低了稠度,但与真溶液相比,仍有显著差别。
胶体电解质的价格高于H2SO4溶液电解质。前者不仅增加了一种原材料,而且制造工艺较直接配制H2SO4溶液还是复杂些,过程也较长,注液也不会和H2SO4溶液那样简单易行。
总之,胶体电解质的研究多有进展,但仍有不少问题,如水化分层、寿命等需不断解决。电解质的研究离不开电极过程的研究,因而也应该考虑与蓄电池和极板的生产结合起来。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




