从1956年在蓄电池正极活性物质与腐蚀膜(corrosion film)中发现α-PbO2晶体【18】,几十年来这方面的研究一直持续不衰。20世纪50年代末,发现了α-PbO2和β-PbO2的不同放电特性【19】。
Pb和O在两种晶体中的排布是不同的。这两种原子排布画在图5-18和5-19中。原子的位置是由X射线衍射分析(X ray diffraction analysis)得到的【20】,图中关于氧的参数已被中子衍射(neutron diffraction)所证实【21】。图中小圆表示Pb原子(A和D),大圆表示O原子(B、C、E、F和G),左下角细实线立方体表示晶胞。图中下半部分图解函数的纵坐标是依赖于经向分布函数(radial distributicn function)和球面质点函数(spherical particle function)的总分布函数(resultant distribution function)G(r),横坐标是径向距离r。
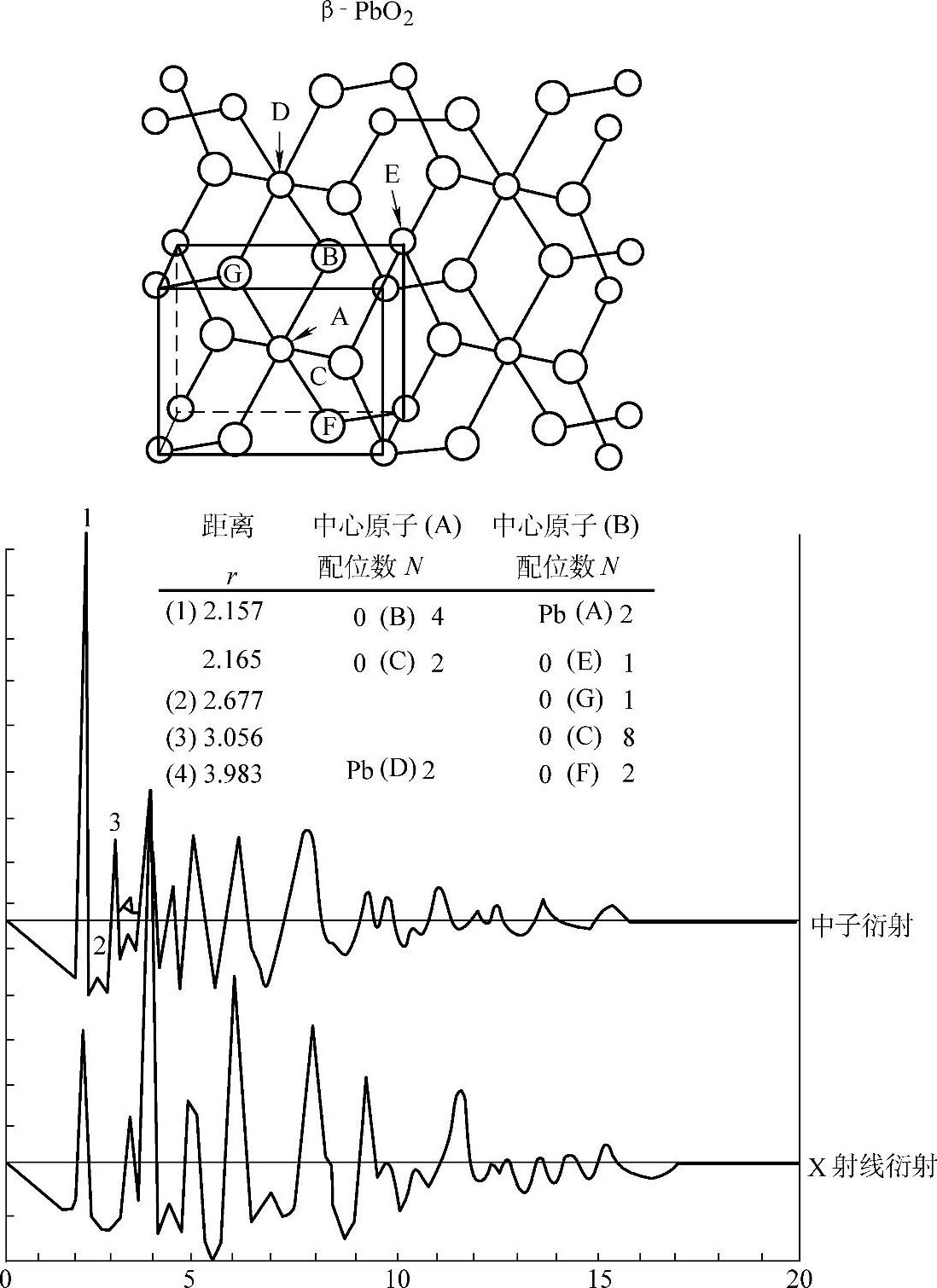
图5-18 β-PbO2中Pb和O原子的排布
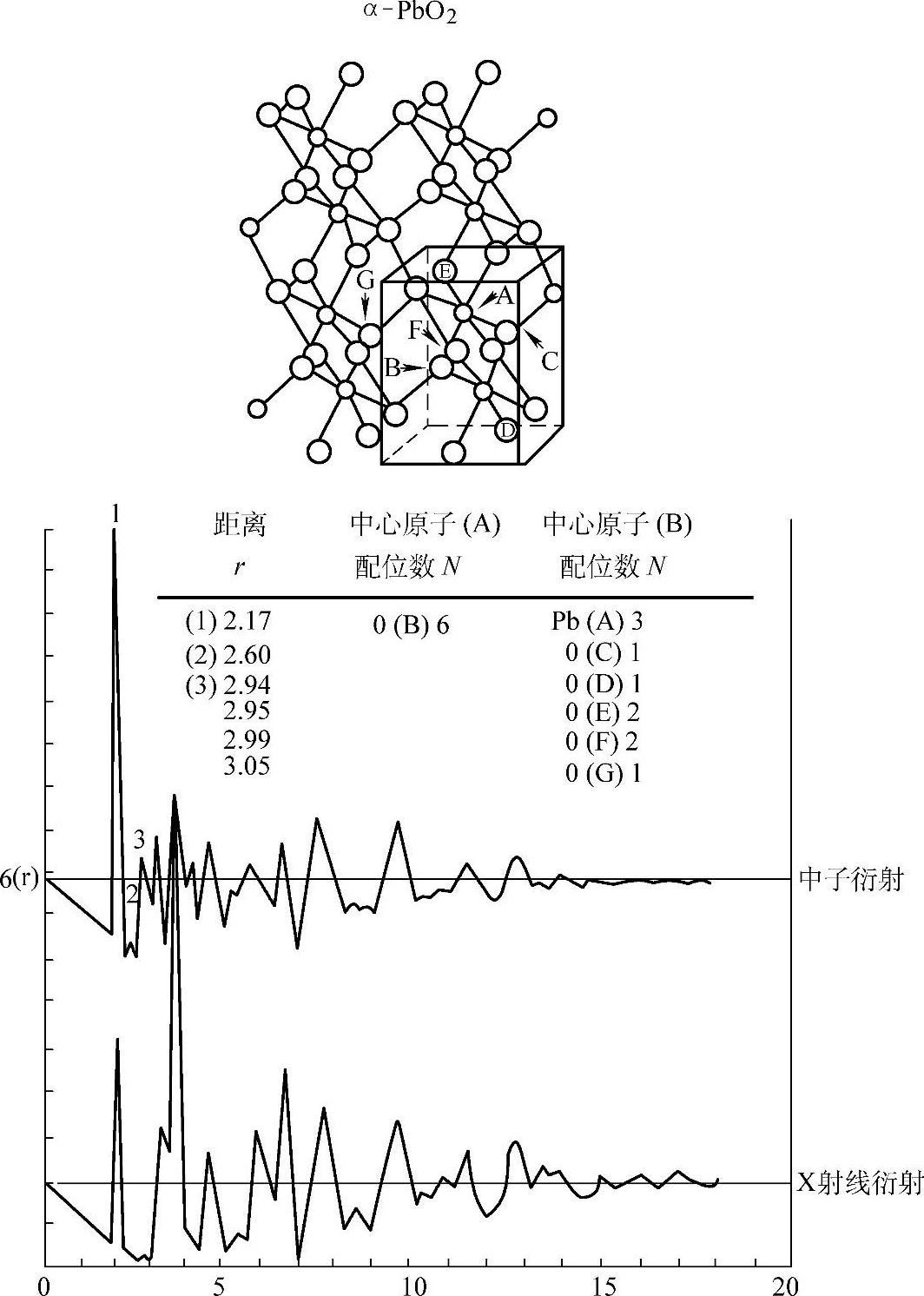
图5-19 α-PbO2中Pb和O原子的排布
二氧化铅是一种含有吸附水和进入晶格中的水或氢氧离子的非化学计量的化合物,铅与氧原子数量的比率(Pb∶O)接近1∶2。以水或氢氧离子形式存在于PbO2中的氢是决定PbO2活性的重要因素,这是多数人的看法【21-23】。(https://www.xing528.com)
β-PbO2的真实比表面积约为9.5m2·g-1,α-PbO2则仅0.48m2·g-1。前者约为后者的20倍。早在20世纪50年代末60年代初,就得出了两种晶体表面积不同的结论【25、26】。
电化学阳极氧化生成PbO2的机理依赖于介质的pH值和电解质溶液中阴离子的种类与浓度。在接近中性或碱性介质中,铅离子与OH-离子络合,经过中间体络合物Pb(OH)22+而形成α-PbO2【27】。在酸性介质中,4价铅离子与HSO4-离子或者SO24-离子络合,经过中间体络合物如[Pb(HSO4)2]2+而形成β-PbO2【28】。
虽然在H2SO4介质中α-PbO2的电极电位高于β-PbO2,但其容量却较小。这是由于其表面积较小并且其晶体与PbSO4同是斜方晶系的缘故。表面积小导致放电时极化严重。电极表面的α-PbO2是形成PbSO4的结晶中心,放电时在α-PbO2表面更快地形成同一晶系的PbSO4晶体。随着蓄电池循环次数的增加,即便是极板微孔深处也逐渐被强酸渗透,形成α-PbO2的环境已不复存在,因而α-PbO2所占比率会逐渐减少,而β-PbO2的比率逐渐增加。这一点可以解释蓄电池的容量在经过若干次循环后会达到一个最大值,以后又逐渐降低的现象。
人们已经认识到,用化学方法制备的α-和β-PbO2是电化学非活性状态的物质。另外在电化学形成的PbO2中是否还存在有无定型的、电化学非活性状态的PbO2,对这一问题的看法还有分歧。一个不易解释的现象是:正极活性物质利用率本来就不高,而且在若干次循环后,蓄电池容量逐步下降。虽然活性物质脱落等机械原因在起作用,但排除这类因素,化学和结构变化的作用也是不容忽视的。尤其是近年来阀控密封式铅酸蓄电池的装配很紧密,活性物质的脱落很少,不足以导致明显的容量下降。除了板栅的腐蚀层之外,无定型非活性PbO2的量的增多也不失为容量下降的一种解释。这可以用循环期间非活性PbO2的量的增加来解释。这一假设和差示热分析(DAT)、热质量分析、高温质谱测定与脉冲核磁共振(NMR)测定的结果是一致的【29】。
有人认为蓄电池正极板的循环寿命受α-与β-PbO2比率的控制,α-PbO2比率大,循环寿命就长。这种现象的一种解释是在化成过程中形成α-PbO2网络结构【30】。我国的研究结果也证明,铅膏酸量增加有利于β-PbO2的生成,但蓄电池的寿命降低了【31】。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




