先把生极板装配成蓄电池,然后注入电解液化成,这就是电池内化成。
生极板在外观上不易区别正极板与负极板,在装配蓄电池的各个工序(如焊汇流排、配极群对、入槽等)中应注意区分,不要混淆。比较简单易行而又行之有效的办法是在极群(strap;post strap)上铸上记号或用黄色蜡笔涂上记号。
生产干式荷电蓄电池必须采用槽化成(极板化成)工艺【11、12、13】。要保证表面积很大,活性很高的负极板在化成之后的干燥过程中不过多地被氧化,就需要水洗、浸渍、干燥等不少设备,劳动量大,消耗能量多,成本高。从20世纪60年代后期,带液蓄电池和湿荷电蓄电池发展很快。到80年代初期,这类蓄电池在美国起动用蓄电池中已占到90%以上。而干式荷电蓄电池仅占百分之几。
90年代后,不仅是固定型备用电源铅酸蓄电池、电动汽车(EV)用动力铅酸蓄电池、电动助力车用铅酸蓄电池等全部采用阀控密封式免维护铅酸蓄电池,而且汽车起动用的阀控密封式铅酸蓄电池也大大扩展了在同类产品中的份额,因而电池内化成工艺也占了压倒优势。
从工艺流程看,发达国家的蓄电池生产较早采用了电池内化成工艺,无论欧洲还是美国都是如此。电池内化成把极板化成与初充电合并为一个工序,化成电流密度小,副反应耗电少,可以节约大量电能。
电池内化成遇到的第一个问题是注入电解液后蓄电池的温升。生极板干铅膏中PbSO4约占15%,PbO约占80%以上。以60A·h的起动用蓄电池为例,其单体蓄电池中干铅膏的质量约为1.0~1.1kg。灌注电解液后发生中和反应
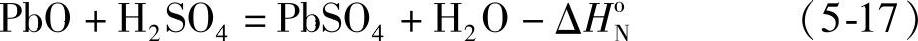
式中ΔHoN=-172.8kJ·mol-1是这一反应的标准状况下的焓变。计算不同浓度的H2SO4溶液与PbO反应的焓变,还要考虑到H2O和H2SO4的相对微分混合热H1和H2,即反应焓变为
ΔHN=ΔHoN+(H1+H2) (5-18)对于密度为1.20~1.22kg·L-1的H2SO4溶液,反应焓变【14】
ΔHN≈-113kJ·mol-1 (5-19)
60A·h单体蓄电池如果注入密度1.20~1.22kg·L-1的H2SO4溶液650~700mL,那么生极板中的PbO约有50%~60%将与H2SO4发生中和反应。参加反应的PbO的量与液温温升之间的关系,大体上可以看成线性关系,即反应的PbO每增加5%,温度就上升3℃【15】。据此推算,温升的幅度为30~36℃,这和实际结果是一致的,因此,如果H2SO4溶液的温度高于20℃,注液过程中或之后采取冷却措施是适宜的,这样才能保证注液后6h内温度降至45℃以下,不延误化成开始的时间,夏季尤其应注意这一点。
牵引用蓄电池一般说热容量大些,注入H2SO4溶液后温升较小。以D-250单体蓄电池为例,注液后温升约为15~20℃(冬季)或更高些(夏季)。不论是起动用或牵引用蓄电池,如果是手工注液,蓄电池码放要留有间隙,以利于散热。
第二个问题是电解液密度的变化。由于生极板不论正、负极板的干铅膏的主要成分是PbO,在中和反应中它是过量的。在注液后,电解液密度会很快下降至和纯水差不多。只是在化成充电开始后一段时间,密度才开始回升。如果选用下面提出的一次注液法(见表5-11),对于起动用蓄电池,铅膏酸量较多(如1000g铅粉用40~50gH2SO4),可以选用密度1.22~1.23kg·L-1的H2SO4溶液作为电解液;铅膏酸量较少时,可以选用1.24~1.25kg·L-1的H2SO4溶液。注入牵引用蓄电池的H2SO4溶液密度不宜超过1.20kg·L-1,因为传统的这类蓄电池完全充电状态下的电解液密度较低而电解液的量较多。
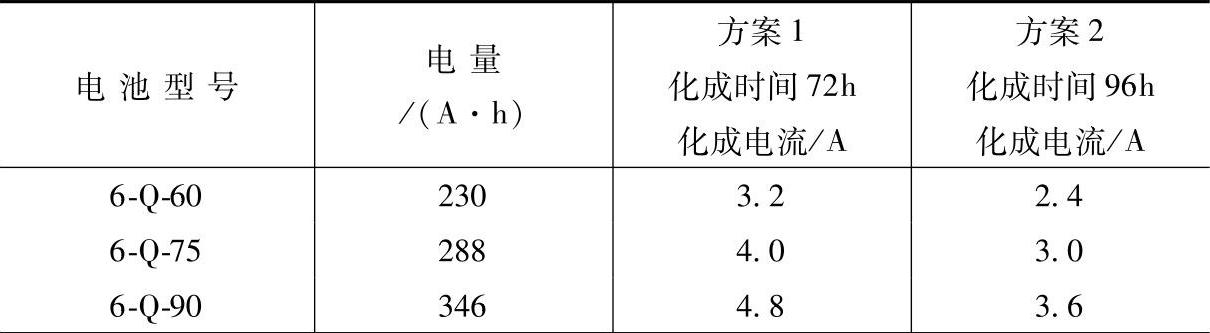
第三个问题是确定化成电流和时间。注入密度1.220~1.245kg·L-1的H2SO4溶液,可采用表5-11两个方案中的任何一个。(https://www.xing528.com)
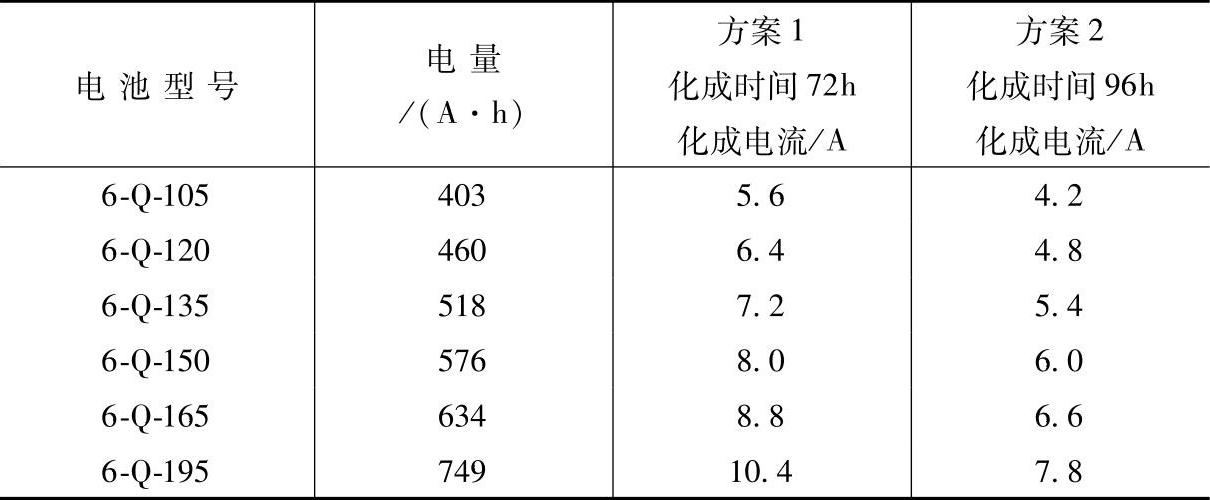
表5-11 一次注入H2SO4溶液法电池内化成的化成电流、时间和电量
(续)
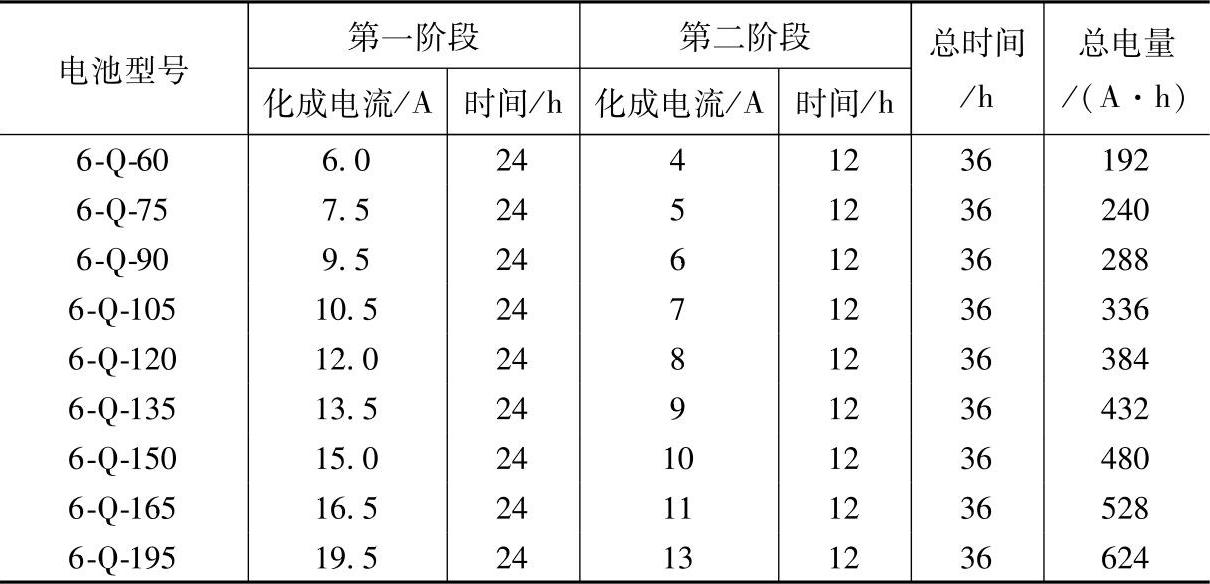
如果要缩短化成时间,可以采用二次注入H2SO4溶液法。第一次注入密度为1.06~1.18的H2SO4溶液,按表5-12分两个阶段化成。化成后将电解液倒出,再注入密度为1.290~1.350的H2SO4溶液,按表中规定的电流和时间补充电,化成结束前如果必要,要调整电解液密度至规定值。
表5-12 二次注入H2SO4溶液法的化成电流、时间和电量
牵引用蓄电池如果用一次注入H2SO4溶液法,化成电流可以用5h率容量的0.05倍,即0.05C5,如D-250蓄电池可用12.5A,化成时间需80~90h,耗用电量约为额定容量的4倍,理论容量的1.4倍。化成过程中电解液密度与单体蓄电池端电压的变化如图5-16与图5-17所示。
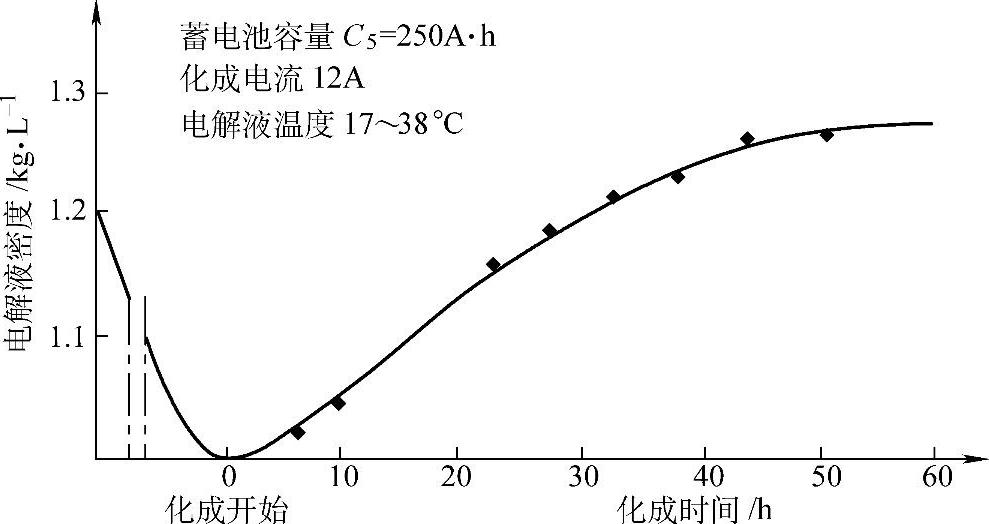
图5-16 牵引用蓄电池电池内化成时单体蓄电池电解液密度的变化
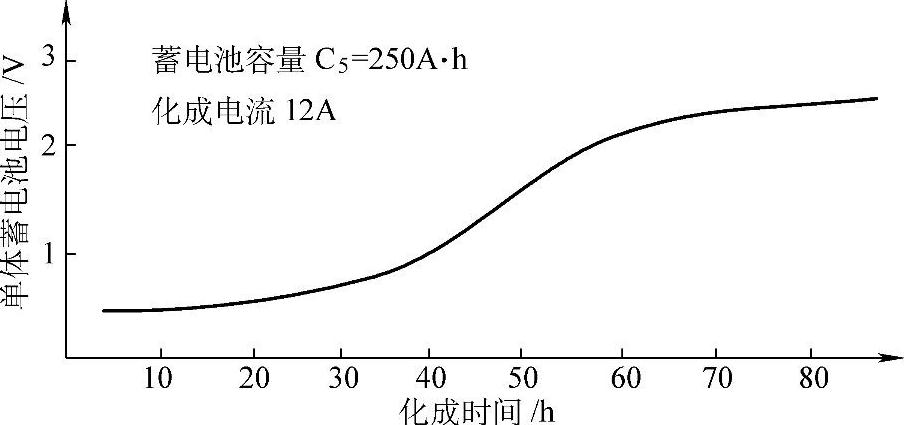
图5-17 牵引用蓄电池内化成时单体蓄电池端电压的变化
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




