干铅膏生极板浸入H2SO4溶液中之后,生极板分两步被浸透。第一步,由于毛细现象(capillary phenomenon),H2SO4溶液先浸满生极板的微孔。孔径越小,H2SO4溶液的扩散浸入越顺利。H2SO4溶液和生极板表面的PbO反应生成PbSO4是中和反应,必然导致附近的孔内部浸满的是浓度很低的酸甚至是水。这一过程进行很快。空气和二氧化碳(CO2)从孔中逸出延缓了这一过程。第二步是酸开始向内部扩散。这一缓慢的过程由于生极板的孔的“类支流”结构(branch-like structure)而进一步被延缓。
如果H2SO4溶液的密度为1.06kg·L-1,生极板的孔率(porosity)约50%,那么,在极板表面形成的硫酸盐层的厚度约为0.025mm;H2SO4溶液的密度如果是1.26kg·L-1,硫酸盐的厚度则为0.12mm。槽化成时浸泡生极板的H2SO4溶液的浓度应当均匀一致。
对于较薄的表面层来说,浸泡0.5~2.0h,由于扩散,一部分活性物质会转化为硫酸盐。精确论述这一问题要考虑许多因素,其中包括微孔引起的扩散的滞缓,而由于PbO变为PbSO4又引起孔的体积变大。极板附近的H2SO4溶液的浓度的降低的作用和扩散滞缓是一致的,尤其是对于电解液的量受到限制的极群化成和电池内化成,这一作用是不容忽视的。
浸透深度X可以表示为反应时间t和有效扩散系数Deff的函数
(X)2=2tDeff(5-1)对于非滞缓扩散,扩散系数D≈2×10-5cm2·s-1(20℃)。如果氧化物和碱式硫酸盐完全变为PbSO4,孔率将从50%降至30%。考虑到孔的曲折情况,有效扩散系数Deff≈10-5cm2·s-1(20℃)。
浸满水的孔的区域总是处于极板的中心位置。和铅膏差不多,此处呈微弱碱性,pH值为9~10。未化成干铅膏内部只有在浸泡时间大于10h或者是酸的密度高于1.20kg·L-1时才会转变为PbSO4,极板中心的pH值约达到5的情况下转变才能完全。
在温度较高的情况下PbSO4会在重结晶过程中生成粗大的晶体,这给化成充电造成困难。虽然浸泡降低了酸浓度,在开始供电化成之后仍然会继续生成PbSO4。化成反应生成H2SO4。生成的H2SO4在化成初期和PbO反应生成PbSO4。以后,生成的H2SO4才会经扩散进入电解液。极板浸泡时的化学反应可以表示为
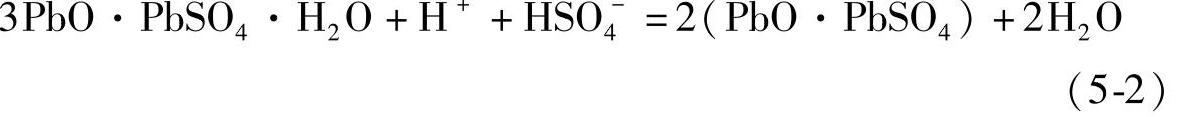
进而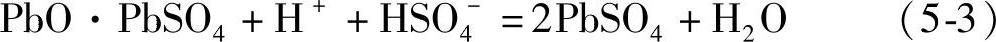
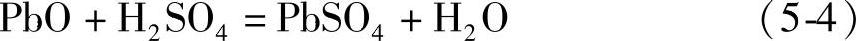
在通以直流电(正极板接外电源正极,负极板接负极)后,在进行上述化学反应的同时,发生电化学反应:
在正极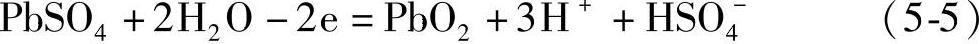
在负极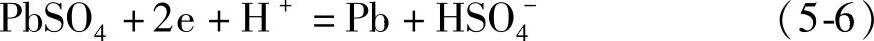
在化成进行的后期,正极电位不断升高,负极电位不断降低,在两极发生析出气体的副反应:在正极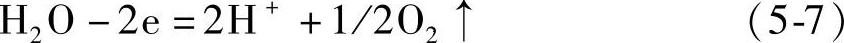 在负极
在负极
随着化成过程的进行,电解液中H+和HSO4-离子浓度不断增大。这不仅是因为电化学反应生成H+和HSO4-,而且还由于副反应消耗水以及水的蒸发使电解液浓度不断增大。
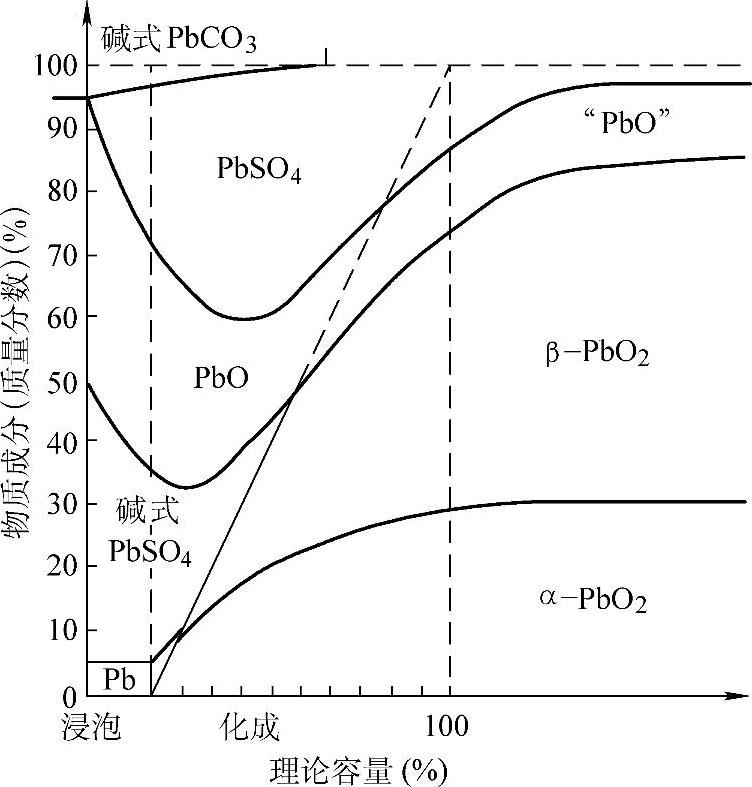
化成过程中正、负极板活性物质成分的变化如图5-4和图5-5所示,温度与电解液密度的变化和两极电极电位(electrode po-tential)的变化如图5-6和图5-7所示【7】。
 (https://www.xing528.com)
(https://www.xing528.com)
图5-4 化成过程中正极活性物质成分的变化
由式(5-2)、式(5-3)和式(5-4)表示的未化成生极板浸入电解液(electrolyte)后的中和反应的焓变是负值(放热反应,见第四章第九节),而电化学反应的焓变是正值(吸热反应):
2PbO=Pb+PbO2 ΔHo=+160kJ (5-9)
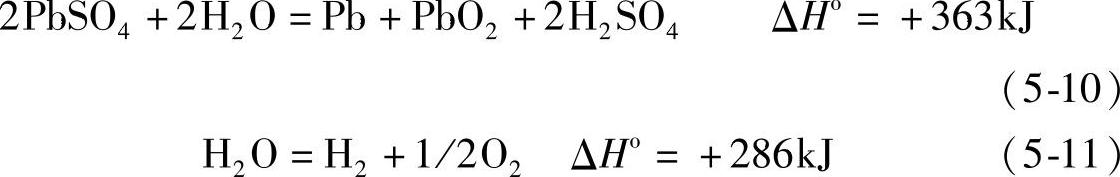
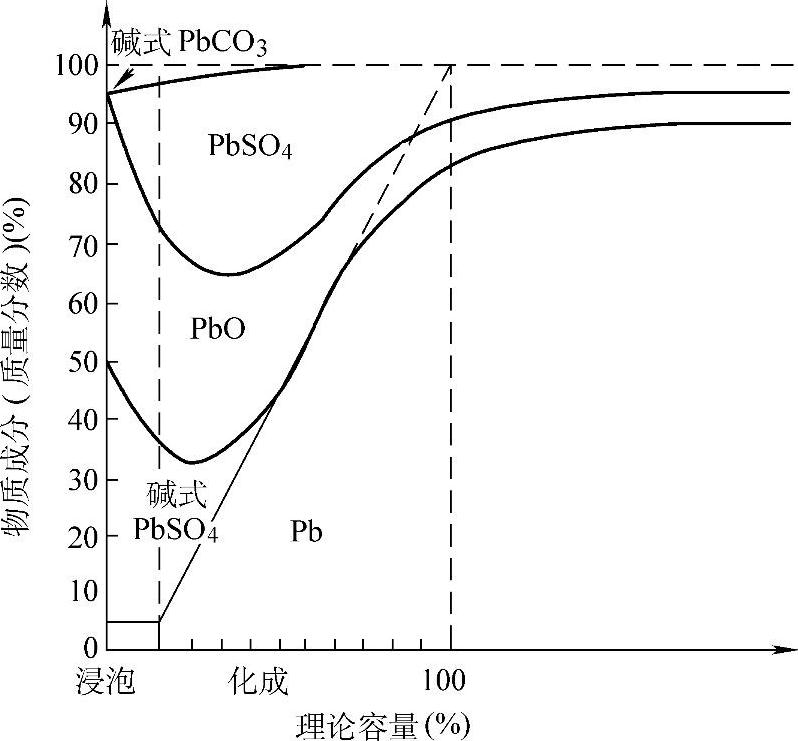
图5-5 化成过程中负极活性物质成分的变化
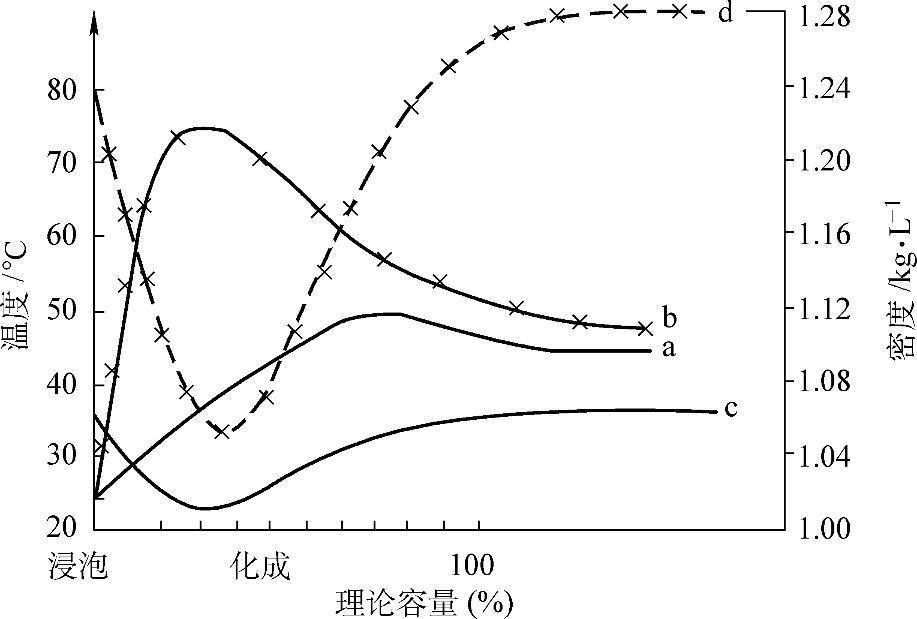
图5-6 化成过程中温度和电解液密度的变化
a—槽化成,温度 b—电池(内)化成,温度 c—槽化成,密度 d—电池(内)化成,密度
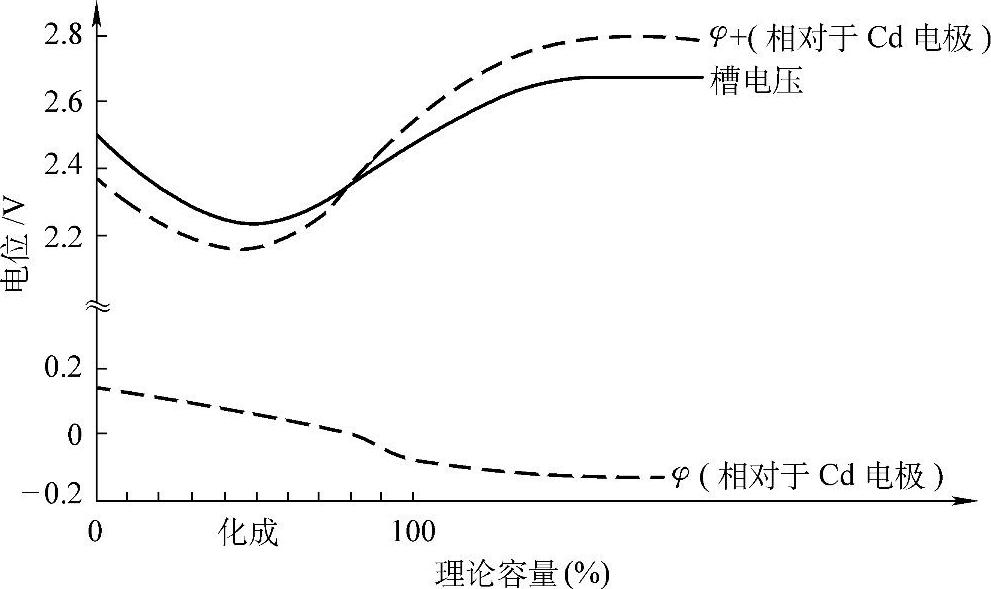
图5-7 化成过程中两极电极电位(以Cd/Cd2+为参比电极)的变化
通电化成时还会由于电流的通过而产生热量。在浸泡及通电化成前期,放热反应及电阻热起主导作用,以后吸热反应及散热逐渐起主导作用。因此图5-4中的温度曲线有一极大值。
由于浸泡时以及通电化成前期中和反应消耗电解液中的H2SO4,电解液密度有一极小值。随着化成的进行,不断生成H2SO4,化成结束时,电解液密度较未化成前会有所增大。
按照全电路欧姆定律,化成过程中的端电压U由下式决定:
U=φ+-φ-+IR (5-12)式中,φ+是正极电极电位,V;φ-是负极电极电位,V;I是化成电流强度,A;R是化成电路中的总电阻,Ω。
φ+和φ-的变化如图5-7所示。由于PbO2晶核的不断生成和长大,过电位减小了,φ+也随之降低。以后随各种极化过电位的增大和氧的析出,φ+又逐渐升高并接近一个恒定值。负极的情况就不同了,Pb2+电化学还原生成Pb的过电位及Pb晶核形成时的过电位都较小,化成开始时负极电位φ-没有明显变化。随着各种极化过电位的影响和氢的析出,φ-逐渐降低并接近一个恒定值。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




