H2SO4在常温下是无色透明的液体。96%~98%的H2SO4(浓H2SO4)在25℃的密度为1.841kg·L-1。纯H2SO4的熔点为10.36℃,含量98%的则为3.0℃。98.3%的H2SO4的沸点为338℃。
铅酸蓄电池生产过程中以及蓄电池本身所用的H2SO4溶液的纯度有严格的要求,可以参看不同国家的标准。一般说即使对H2SO4溶液纯度要求较高的阀控密封式铅酸蓄电池(Valve-regu-lated lead-acid battery;VRLA;VRLAB)使用分析纯试剂(ana-lytical reagent;AR)配制H2SO4溶液就能符合要求。
配制H2SO4溶液,只能把浓H2SO4缓慢加到纯水中去并不断搅拌;不允许把水加到浓H2SO4中!
H2SO4溶液不仅是铅酸蓄电池及其化成工序的电解质溶液,而且还是电极反应的活性物质。铅酸蓄电池电解液中H2SO4的量是决定蓄电池容量的因素之一,有些情况下是制约因素。
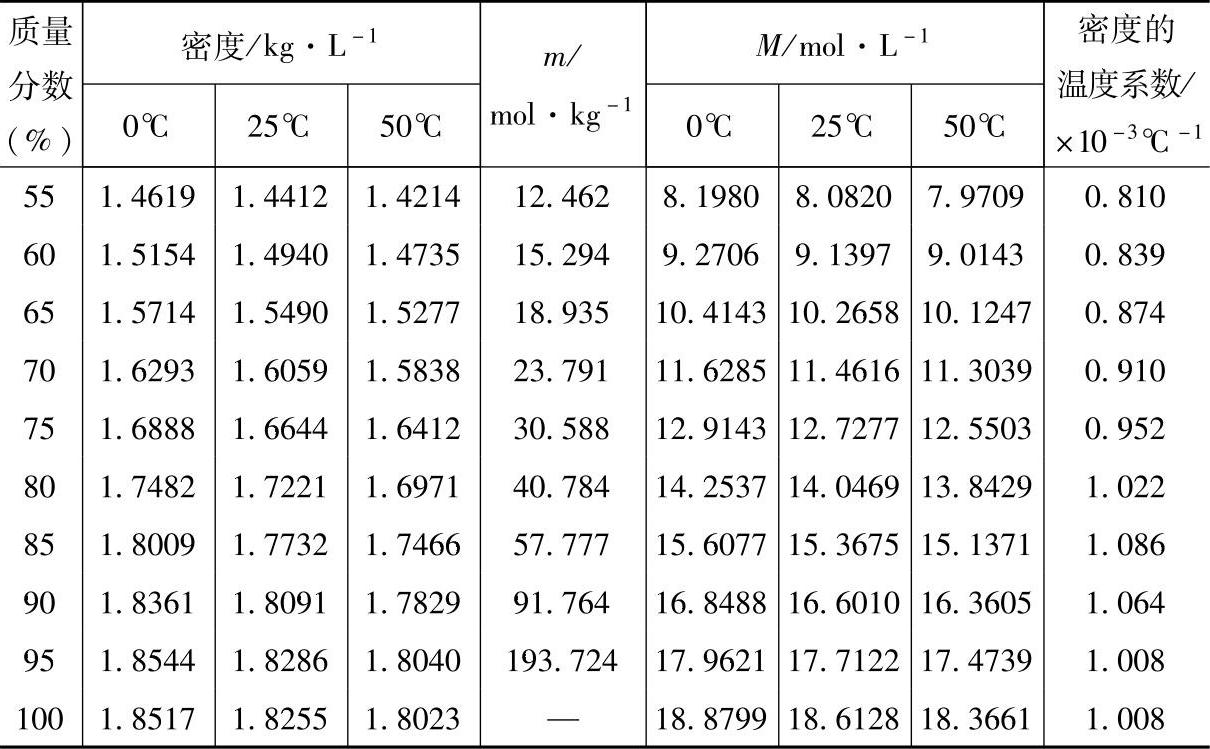
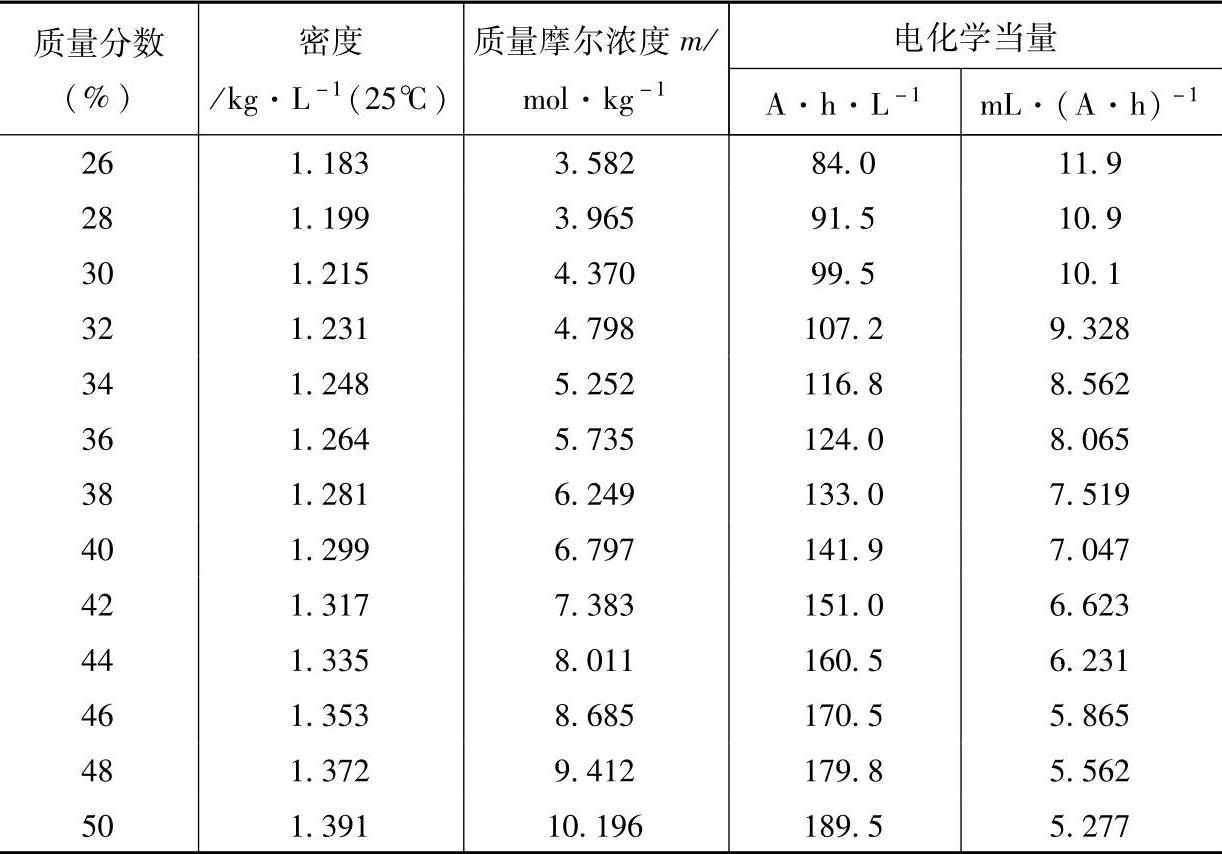
除温度之外,铅酸蓄电池的电动势几乎只依赖于H2SO4溶液的浓度。而H2SO4溶液的浓度有不同的表示方法。工业生产中常用质量百分含量和密度,实验室常用(体积)摩尔浓度(molar concentration)即单位体积溶液中溶质的摩尔数,常用M表示或质量摩尔浓度(molality)即1kg溶剂中所含溶质的摩尔数,常用m表示。涉及某些物理化学性质的研究中又常用摩尔分数(mole fraction)。不同方法表示的H2SO4溶液浓度之间的关系见表5-1【1】。
表5-1 不同方法表示的H2SO4溶液浓度之间的关系
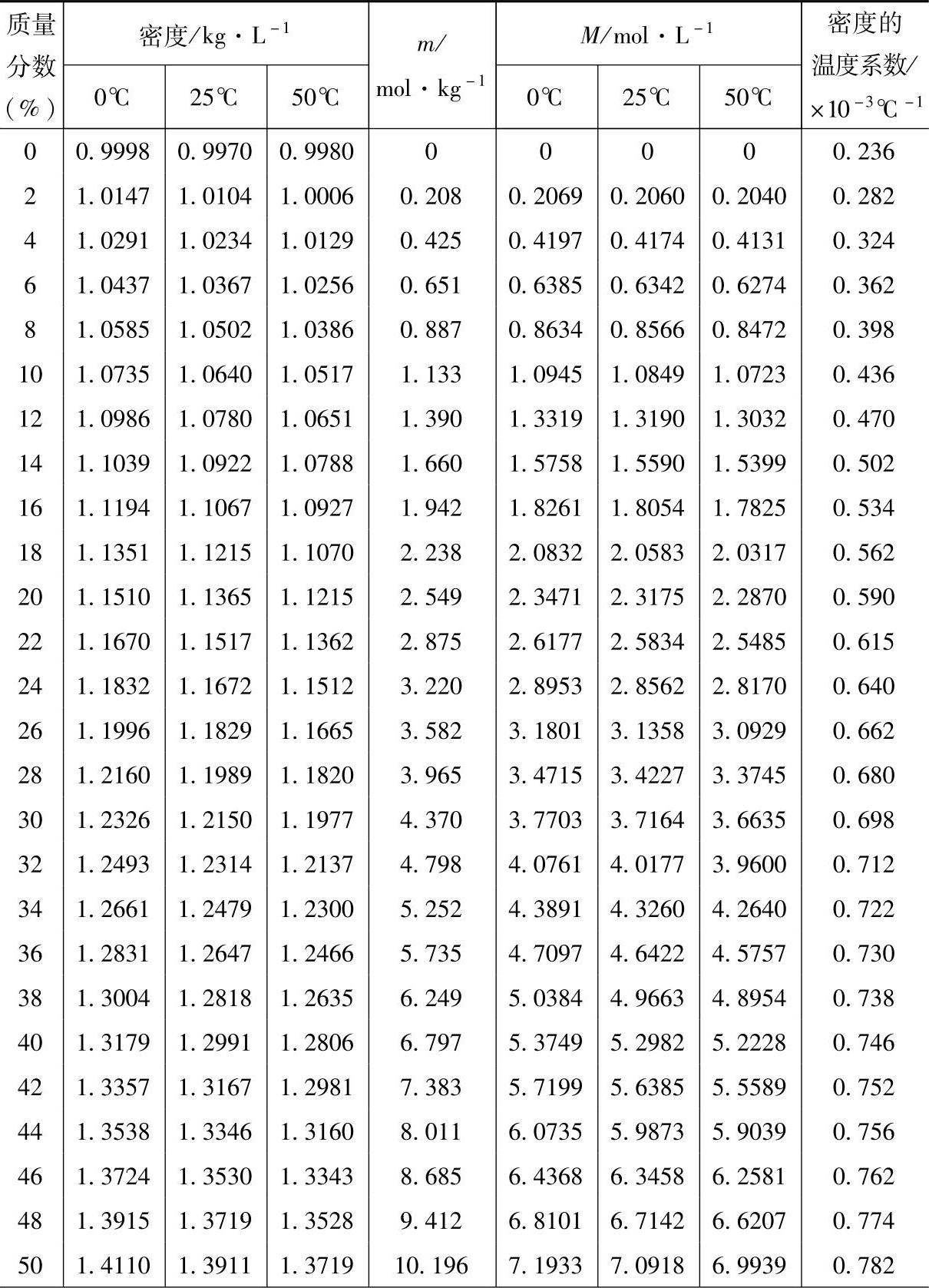
(续)
H2SO4作为活性物质按照下面的反应参加电池反应
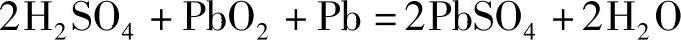
可知2mol H2SO4参加反应,理论上流过的电量为2倍法拉第(2F,即2×26.80A·h)。据此计算出的H2SO4溶液的电化学当量(electrochemical equivalent)见表5-2。
表5-2 H2SO4溶液的电化学当量
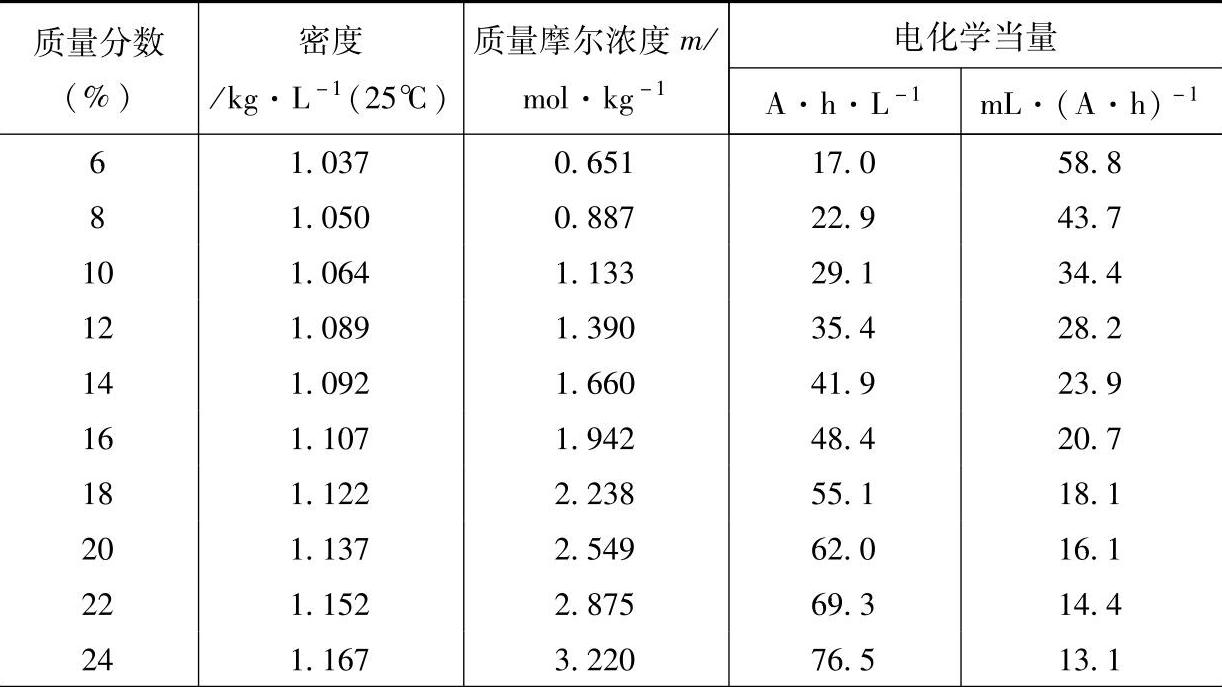
(续)
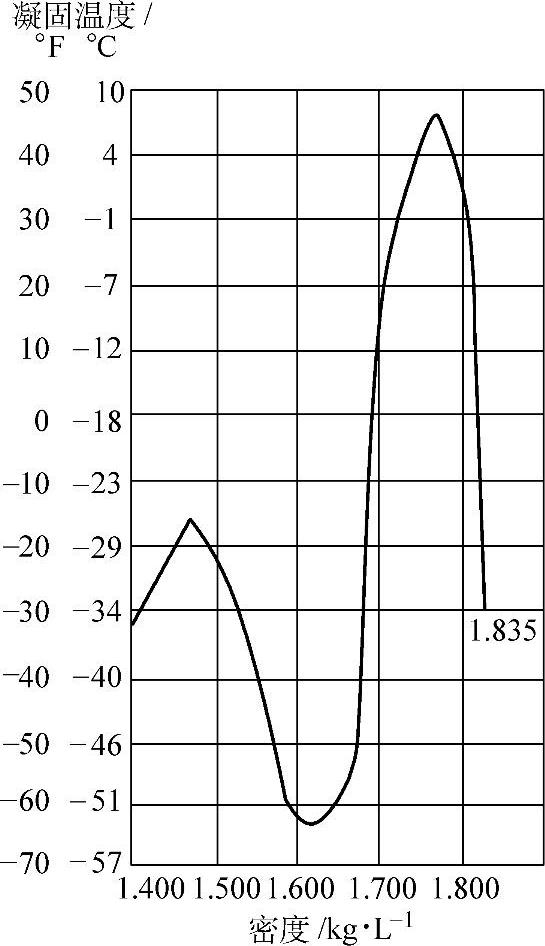
铅酸蓄电池有时需在环境温度很低的情况下工作,放电后的电解液的浓度也很低,这就要求我们应该了解H2SO4溶液的凝固点(freezing point)随着浓度的变化情况。有关数据可参考表5-3和图5-1与图5-2【3】。
表5-3 H2SO4溶液的凝固点【2】
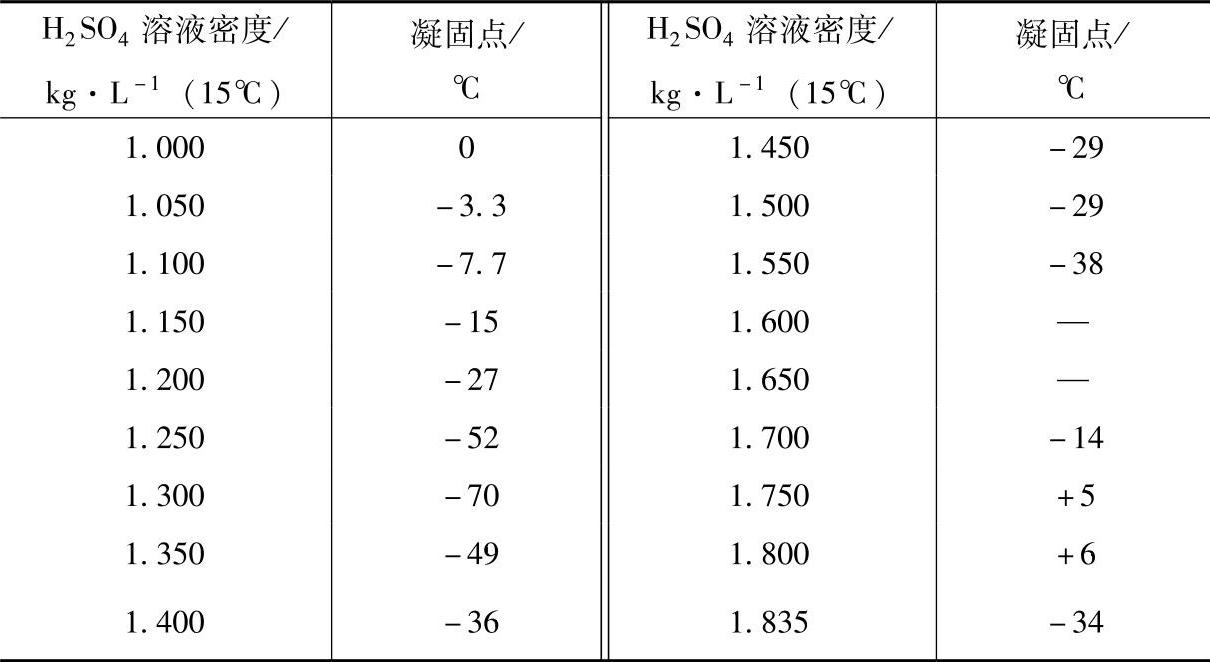
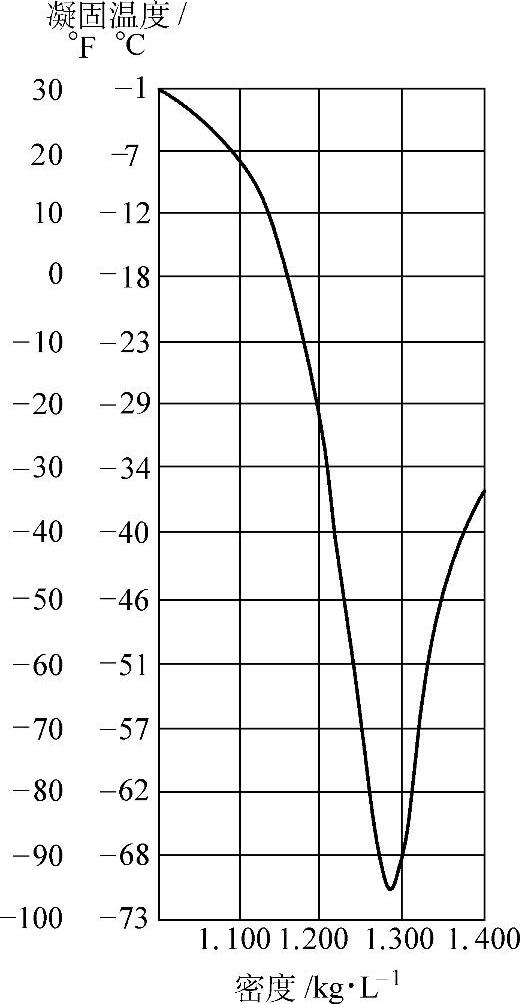
图5-1 H2SO4溶液的凝固温度与密度的关系(1)
 (https://www.xing528.com)
(https://www.xing528.com)
图5-2 H2SO4溶液的凝固温度 与密度的关系(2)
H2SO4的黏度(viscosity)在不同温度、不同浓度差异很大,在很大程度上影响着H2SO4溶液的电导和蓄电池的放电电流和容量。这里的黏度指动力黏度(dynamic viscosity),用来表示液体内摩擦的大小。有关数据见表5-4。
表5-4 H2SO4溶液的黏度【4】
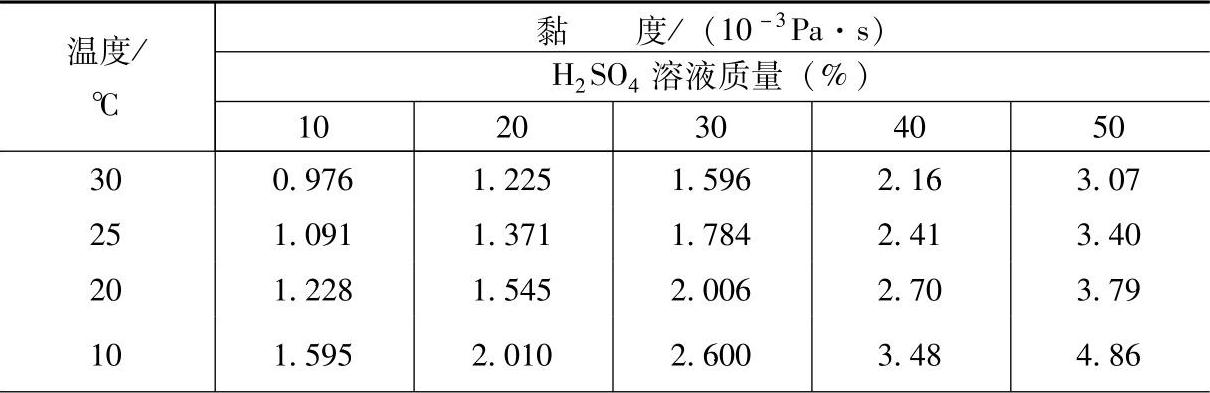
(续)
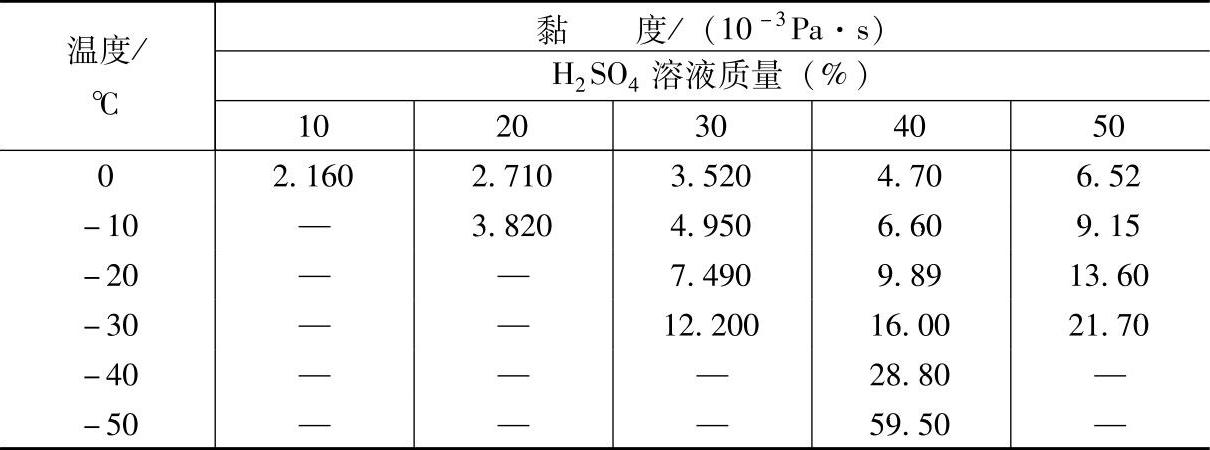
注:“—”表示溶液已凝结或结晶。
H2SO4溶液作为铅酸蓄电池的电解质溶液,其导电性能无疑是最为人们关注的物理特性之一。表5-5列出不同浓度的H2SO4溶液的电导率κ、当量电导率Λ及其温度系数。电导率(con-ductivity)κ指的是单位长度、单位截面积的物体的电导(con-ductance)。电导是电阻的倒数,以西门子(S)为单位。如果电阻以欧姆(Ω)为单位,电导的单位S就是Ω的倒数,即S=Ω-1。当量电导率(equivalent conductivity)定义为在两片距离为10mm的平板电极(面积无限制)之间,含有1当量(就H2SO4溶液来说,即含有0.5molH2SO4)电解质的溶液的电导。这一物理量亦可认为是H2SO4溶液的摩尔(1/2H2SO4)电导率。这里在摩尔之后指定1/2H2SO4。
表5-5 H2SO4溶液的电导率、当量电导率及其温度系数(18℃)【5】
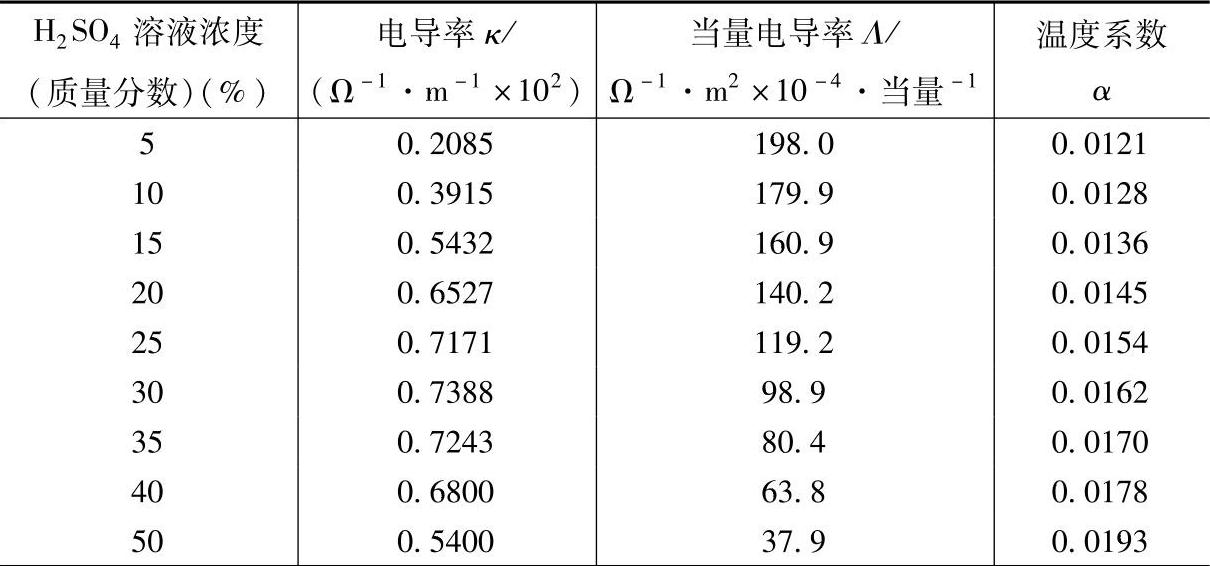
(续)
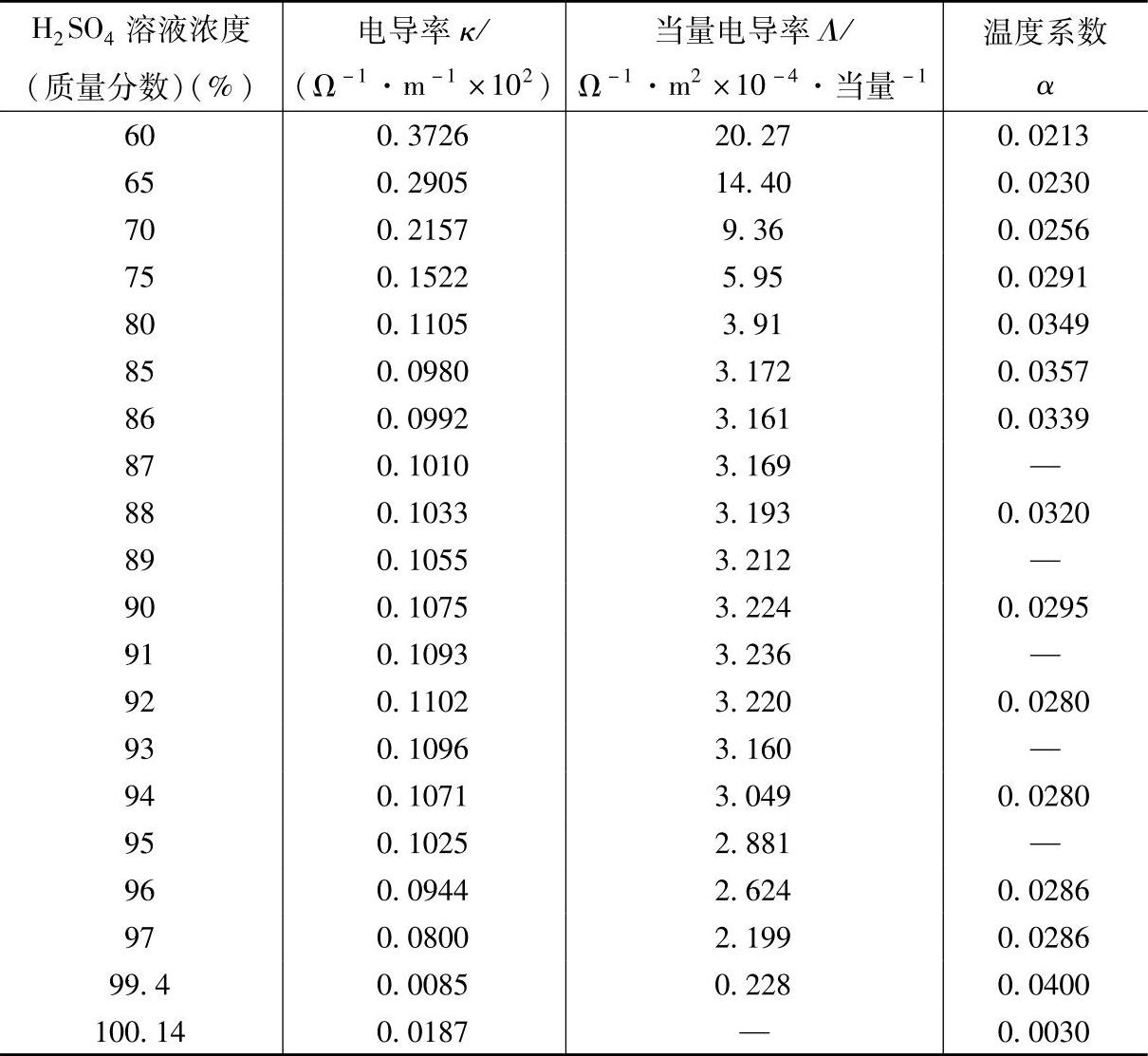
表5-5 中的温度系数α的值是从t=18℃和t=26℃的电导率的测定值按下式计算得到的。
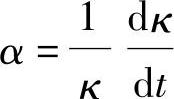
例如,求10%H2SO4溶液在20℃的电导率κ20和当量电导率Λ20,可计算如下:
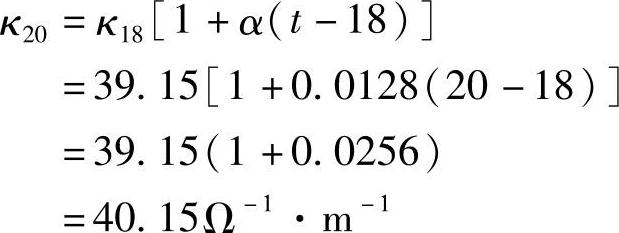
求Λ20之前可先求稀释度φ,即当量电导率的倒数
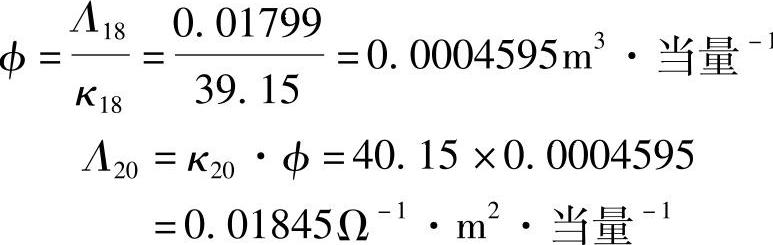
参考文献【1】74页用图示的方法表明了不同温度下H2SO4溶液的电导率与浓度的关系(见图5-3)。
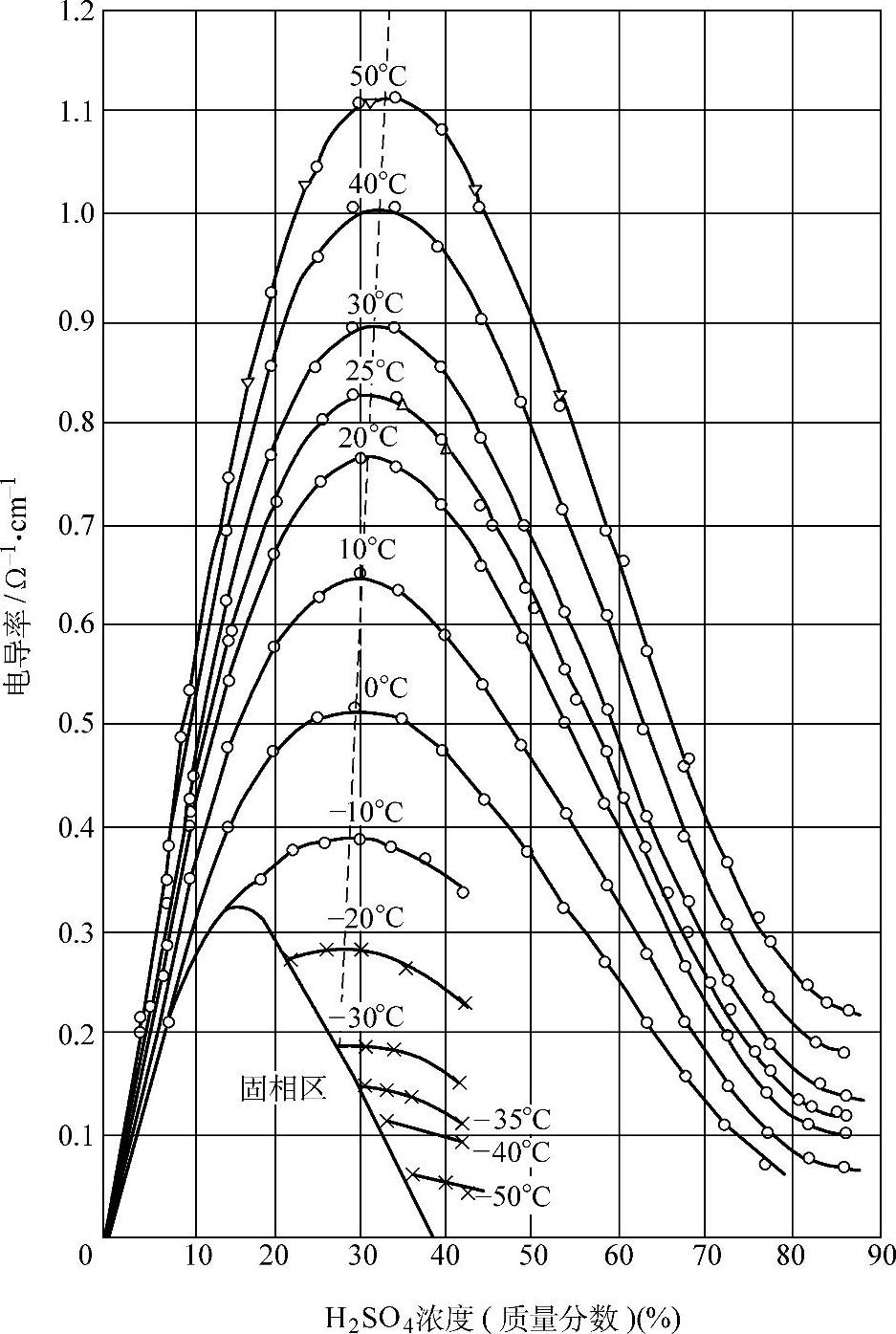
图5-3 H2SO4溶液在不同温度下的电导率对于温度的依赖关系
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




