和膏过程中铅膏的温度影响铅膏的组成。一般要求在加酸时的最高温度达到68℃。搅拌持续到温度降至约40℃。这就要求和膏机要有良好的冷却系统。
伴随着和膏的进行,产生大量的热。热量的来源主要是化学反应和机械摩擦。前者包括铅粉中的游离金属铅的氧化的反应热(这一反应主要发生在过程的初始阶段);PbO与硫酸的中和反应热,特别是和膏时加入硫酸较多、所用H2SO4溶液浓度较大时,中和反应产生的热量更大。机械摩擦产生的热量,所谓摩擦热则视和膏机的功率和工作时间而定。除此之外,生成氢氧化物或水合物也产生热量,但较少。在表面积较大的物质中加上水,在既无氧化作用,亦无中和反应的情况下,也会有热效应,此即所谓量值不大的“润湿热”(heat of wetting)【21】。
和膏过程可以认为是不做非体积功(如电功)的等压过程,体系的焓变ΔH与其吸收的热量Qp相等,即ΔH=Qp。把体系在过程中放出的热量-ΔH称为过程的热效应。
不言而喻,和膏过程的热效应依赖于和膏工艺条件。如果在和膏之前把H2SO4稀释并冷却至室温再用来和膏,那么这一过程中的混合热效应就不能算在和膏过程的热效应之内。把浓H2SO4加入铅膏,反应热效应中包含有冲淡热效应。还有,铅粉中加入的H2SO4量较多,中和反应热效应就大。
先考虑H2O—H2SO4体系中的稀释热,也称冲淡热(dilution heat;heat of dilution)。设有一个H2O—H2SO4体系,在等温等压的条件下,体系的焓ΔH′是H2SO4的摩尔数n2与H2O的摩尔数n1的函数,即
ΔH′=f(n1,n2) (4-45)这个式子的微分表达式是

为书写简单,令

式(4-46)就可以写成

H1是H2O—H2SO4体系的微分稀释热(differential heat of di-lution), 是体系的微分溶解热(differential heat of solution)。
是体系的微分溶解热(differential heat of solution)。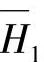 和
和 也分别称为H2O和H2SO4的微分混合热(differentialheat of mixing),其值可由实验测定(见图4-8)。
也分别称为H2O和H2SO4的微分混合热(differentialheat of mixing),其值可由实验测定(见图4-8)。
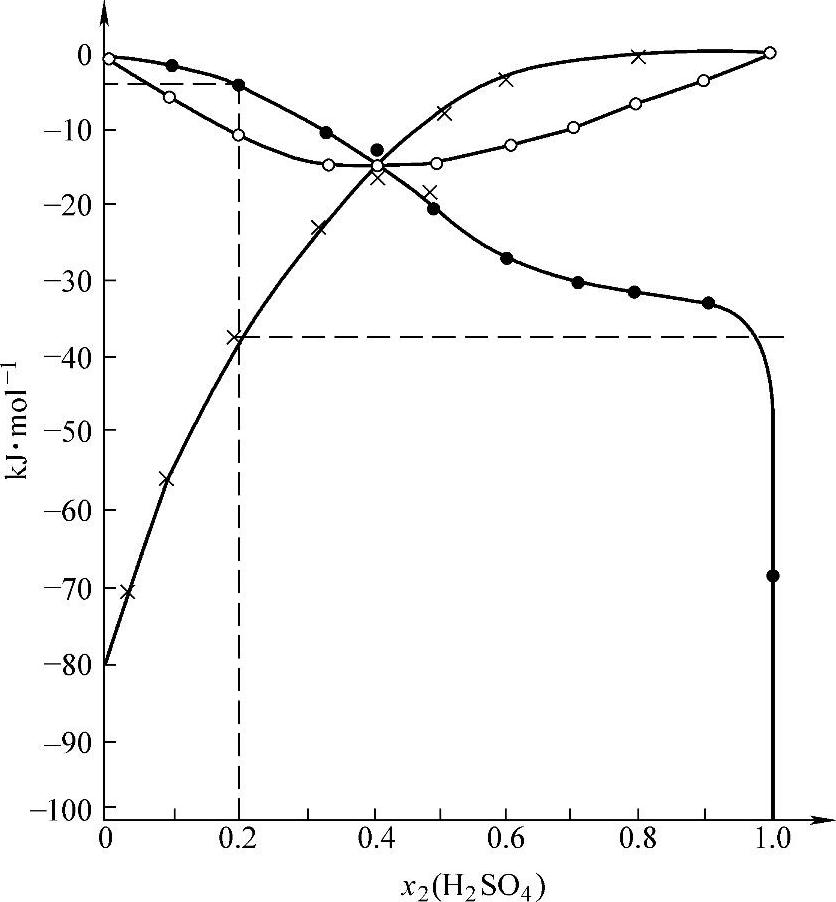
图4-8 H2O—H2SO4体系(25℃)的微分稀释热H1、
微分溶解热H2和混合积分热ΔH对于摩尔分数x2的依赖关系

设想把体系总量由零增加到n·mol,那么,体系的焓也由零增加到ΔH′,即把式(4-47)积分

注意体系的摩尔数n就是H2O与H2SO4的摩尔数之和,n=n1+n2。用x1和x2分别表示H2O和H2SO4的摩尔分数,即

由n1=nx1和n2=nx2得到

式(4-48)可以写为
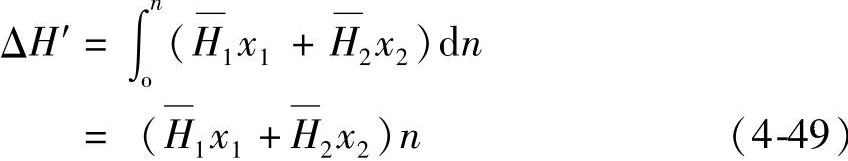
得到
用ΔH表示1mol H2O—H2SO4体系的混合热,(mixing heat;heat of mixing)其式为
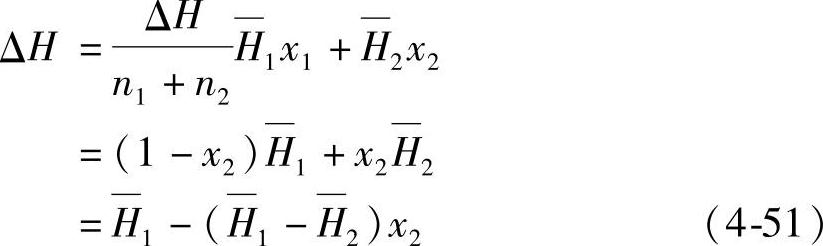
这样,ΔH可以表示成x2的函数(图4-8)。
图4-8是根据实验数据绘制的。一部分实验数据列在表4-13中。
表4-13 H2O(1)—H2SO4(2)体系在25℃时的质量摩尔混合热ΔH、偏摩尔混合热和硫酸的积分溶解热对于n1/n2、x2和m2的关系

表4-13中的m2是质量摩尔浓度,即1kg溶剂(H2O)中溶解的溶质(H2SO4)的摩尔数。图中通过x2=0.2的垂直虚线与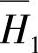 、
、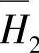 和ΔH线分别相交的交点表明
和ΔH线分别相交的交点表明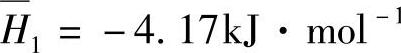 、
、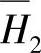 =-37.2kJ·mol-1和ΔH=-10.79kJ·mol-1。
=-37.2kJ·mol-1和ΔH=-10.79kJ·mol-1。
根据图4-8或表4-13的实验数据可以计算稀释热。例如计算3kgH2SO4稀释成15.4%的溶液的热效应。由图4-8或表4-13查得

溶液中的H2O的质量为16500g,H2SO4为3000g,则
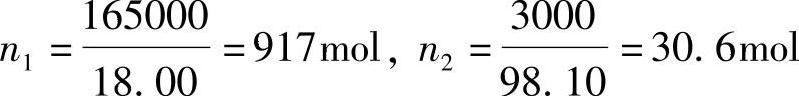
将这些数据代入式(4-50)得到
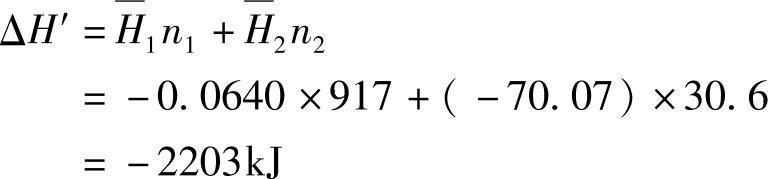
可知热效应为2203kJ。同样,可以计算出3kg H2SO4稀释成31.2%溶液时的热效应为2129kJ。稀释成40.5%溶液时则为1962kJ。(https://www.xing528.com)
为了计算H2SO4溶液从一种稀释至另一种浓度释放出的热量,引出一个概念ΔH′/n2,即1mol溶质的混合热。
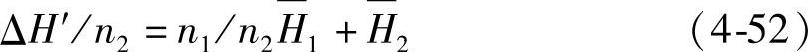
将ΔH′=(n1+n2)ΔH代入式(4-52)得到
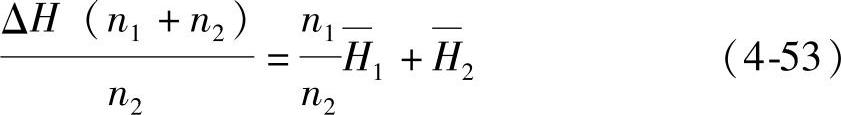
注意到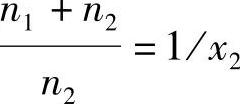 和n1/n2=x1/x2,式(4-53)就可以写成
和n1/n2=x1/x2,式(4-53)就可以写成

ΔH′/n2或ΔH/x2叫做积分溶解热(integral heat of solution),它是x1/x2的函数(见图4-9)。
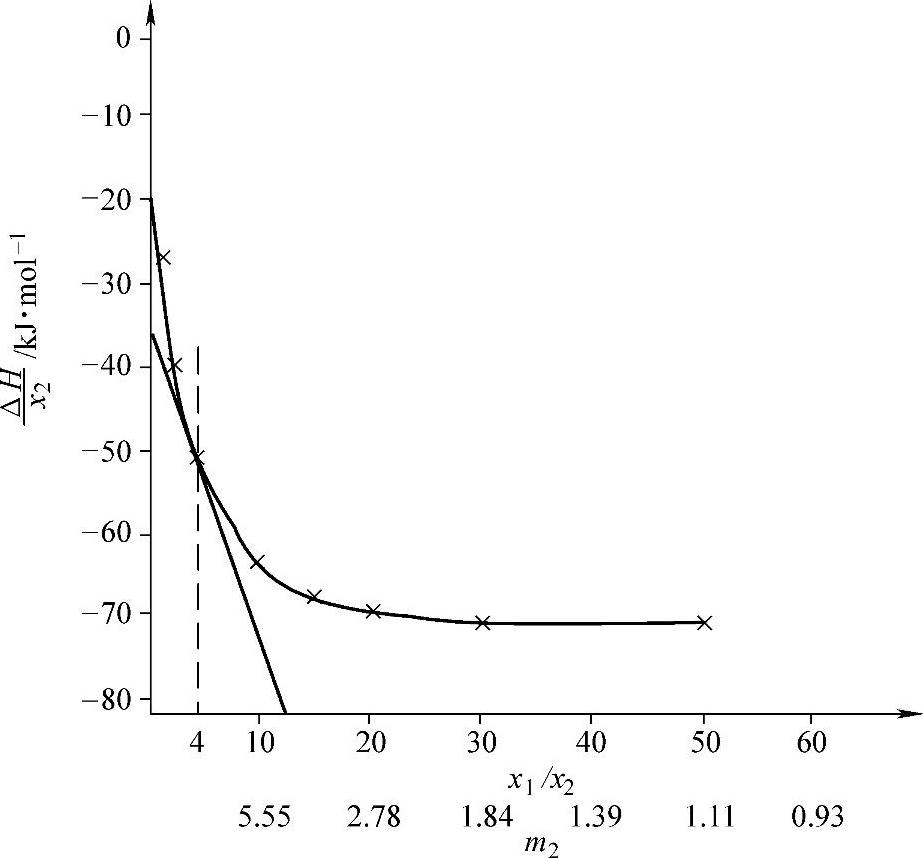
图4-9 H2SO4的积分溶解热ΔH/x2对于摩尔分数比值x1/x2的函数关系
求ΔH/x2=f(x1/x2)的导数得到

曲线在某点的切线的斜率就是该浓度时的H1值。例如,当x1/x2=4(即x2=0.200)时,该点的切线斜率为-4.167(见表4-13)。该点的函数值ΔH/x2=-53.9。过点(4,-53.9)、斜率为-4.167的直线(切线)与ΔH/x2轴的交点的纵坐标值为 =-37.2(见表4-13)。切线的方程是
=-37.2(见表4-13)。切线的方程是

把x1/x2=0代入方程得到ΔH=-37.2。由式(4-54)知,当x1/x2=0时,x2=1,有ΔH=H2,所以有H2=-37.2。
随着溶液浓度变小,即x1/x2→∞或m2→0,曲线变平,函数值趋向定值,曲线切线的斜率趋近于零,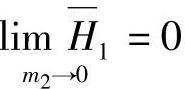 。此时溶剂的微分稀释热等于零。此时的积分溶解热的极限值用符号H02表示如下式:
。此时溶剂的微分稀释热等于零。此时的积分溶解热的极限值用符号H02表示如下式:
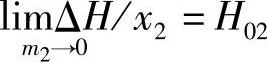
相当于1mol H2SO4溶解成无限稀释的理想溶液的混合热。
H2SO4在水溶液中不仅溶解,而且还要电离

在较低的浓度(m2<1)时,第二步电离才显著进行。如果把1mol H2SO4在标准状况(25℃,101325Pa)下稀释成无限稀释的溶液,视其为2—1型电解质并且完全电离,则此过程的焓变为

含有1mol H2SO4的溶液,从一种浓度m2稀释到另一种浓度m2′的焓变是后者与前者积分溶解热之差。例如一个H2O—H2SO4体系的浓度m2=9.291,其中含有1mol H2SO4,将它稀释成m2′=1.850,过程的焓变为
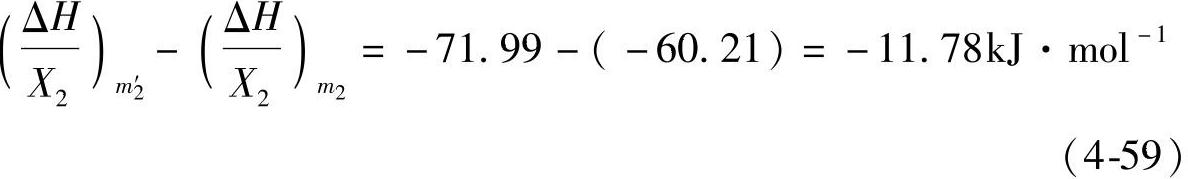
现在来讨论和膏过程中的热效应。我们把和膏中的化学反应简化为铅的氧化及中和反应。铅的氧化反应式 Pb+1/2O2=PbO (4-60)
ΔHo 0 0 -219kJ·mol-1
设计合理的和膏机与正确的和膏工艺程序应当保证和膏过程中生成的氧化铅仅占整个铅粉质量的5%左右而不应大于10%。如果100kg铅粉在和膏过程中,由于氧化反应生成5kgPbO,那么释放出的热量就有4908kJ。
中和反应 H2SO4+PbO=PbSO4+H2O (4-61)
ΔHo -814.1 -219.1 -920.0 -286.0kJ反应的焓变

如果在100kg铅粉中加入3kgH2SO4,那么中和反应的焓变就是-5284kJ。这是就纯H2SO4与PbO在标准状况下反应而言。不同浓度的H2SO4溶液与PbO在标准状况下反应的焓变ΔHN是ΔHoN与该浓度下的H2O—H2SO4体系的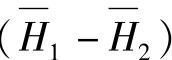 之和
之和

表4-14列出几种不同浓度的H2SO4溶液与PbO的中和反应的焓变。
表4-14 H2SO4溶液与PbO的中和反应的焓变

至于提到铅粉的润湿热,因为其值较小,这里予以忽略。
由于机械摩擦产生的热量很难定量计算,这一部分热量主要是在加水和加酸过程中产生的。为了把干的铅粉与添加剂混合均匀的干搅拌所需要的功率与机器空载相差无几。
和膏过程中热量损失主要是水的蒸发和环境散热造成的。水的汽化热为40.67kJ·mol-1。环境散热导致的热损失是次要的。
只有全面考虑和膏过程中热量的产生与损失以及铅膏中各组分的量与热容、和膏工艺程序的正确与否、设备的热容与散热,才能正确估算并控制铅膏的温度。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




