根据铅酸蓄电池在充放电过程中的电极反应和电池反应:
正极反应PbO2+3H++HSO4-+2e=PbSO4+2H2O
负极反应Pb+HSO4--2e=PbSO4+H+
电池反应PbO2+Pb+2H2SO4=2PbSO4+2H2O可以知道,伴随着2F(2×26.80A·h)电量的转移,在负极和正极分别有1mol的铅的化合物参加电化学反应。因而金属铅Pb的电化学当量是
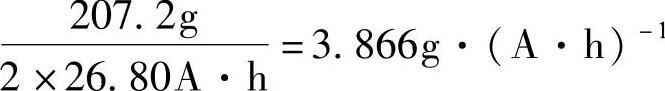
如果用PbO作为正极或负极活性物质原料,经过一系列的化学和电化学变化,1mol PbO最后仍然是1mol PbO2或是Pb。因而PbO的电化学当量是
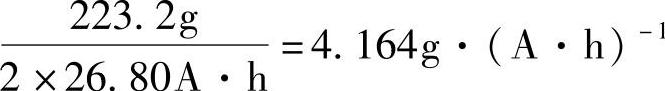
实际上,铅酸蓄电池极板活性物质原料是铅粉——Pb和PbO的混合物。铅粉的电化学当量和它的氧化度有关【5】。
设1mol金属Pb生成氧化度x的铅粉后其质量为M,铅粉里含Pb的摩尔数为m1,则

式中,MPb是Pb的摩尔质量。铅粉里含PbO的摩尔数为m2,则

式中,MPbO是PbO的摩尔质量。
由于m1+m2=1所以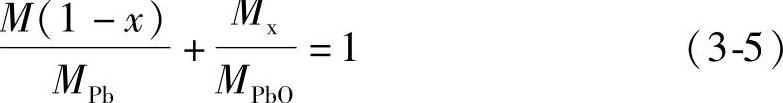 式(3-5)经过整理化简得到
式(3-5)经过整理化简得到
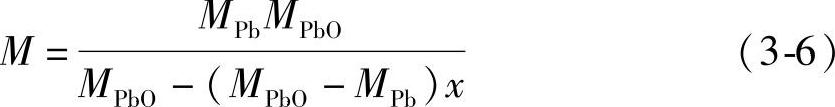
用C表示铅粉的电化学当量
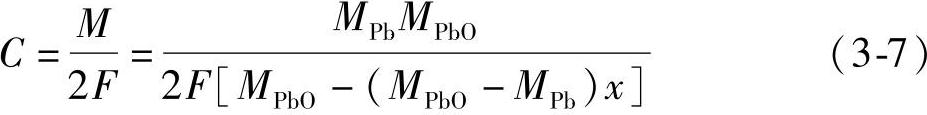
式中,MPbO=223.2g·mol-1;MPb=207.2g·mol-1;F=26.80A·h·mol-1。把这些数值代入式(3-7),得到C(g·(A·h)-1)

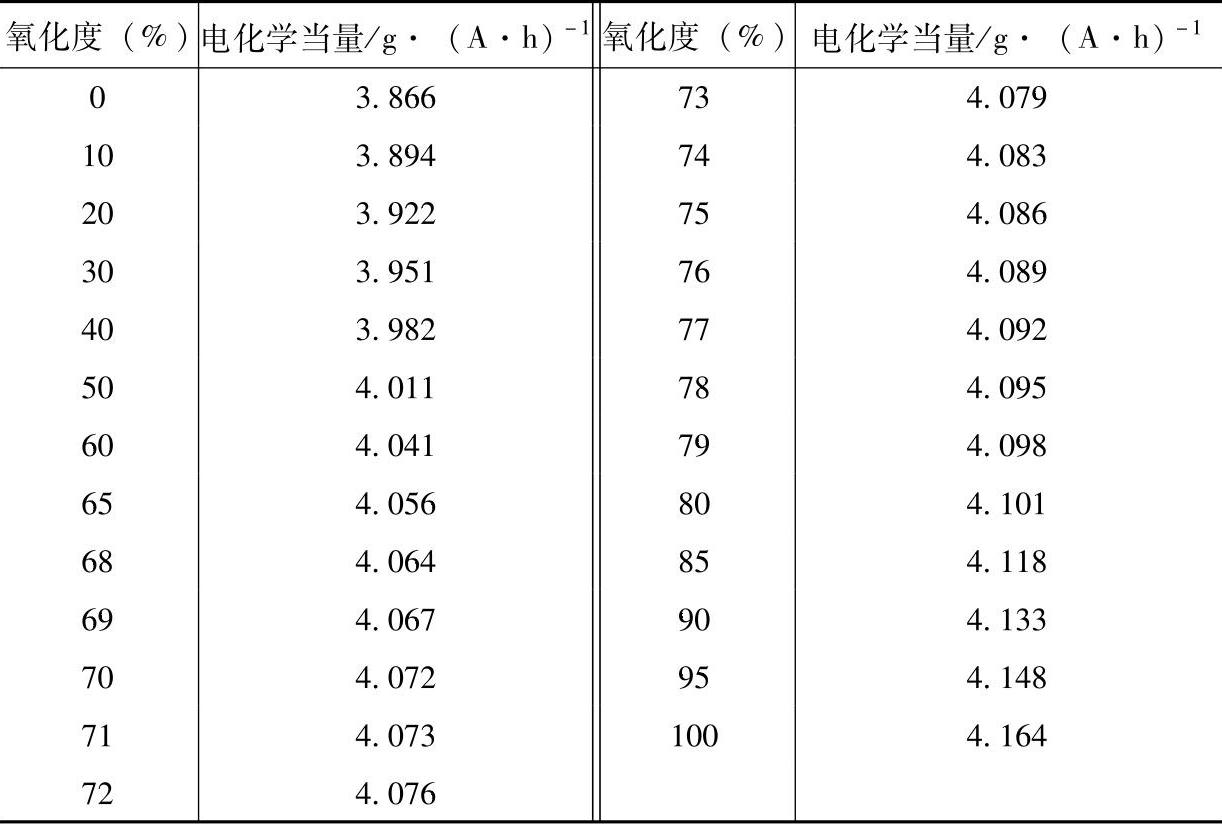
铅粉的电化学当量依赖于铅粉氧化度x。不同氧化度的铅粉的电化学当量见表3-9。
表3-9 不同氧化度的铅粉的电化学当量
许多铅酸蓄电池生产厂家制造极板的铅粉中添加有Pb3O4(PbO2·2PbO)或者PbO2。这种混合铅粉的电化学当量又该如何计算呢?先看Pb3O4和PbO2的电化学当量的计算。Pb3O4分子中包含3个Pb原子,即1molPb3O4中包含3mol Pb原子。在铅酸蓄电池极板中Pb3O4经过一系列变化,理论上最后是伴随着3×2F(3×2×26.80A·h)电量的转移,有1mol(685.6g)Pb3O4参与电极反应,因而Pb3O4的电化学当量CPb3O4应是
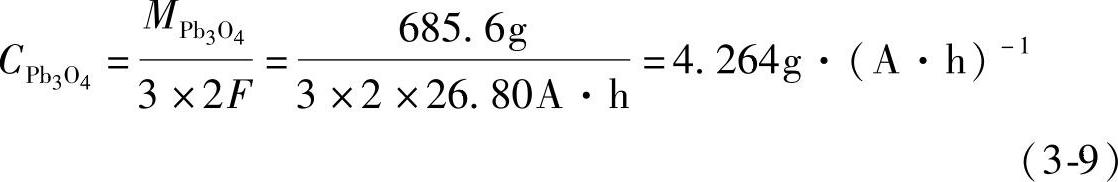
然后再来计算添加Pb3O4的混合铅粉的电化学当量。
假定总质量为M的混合铅粉中含有的Pb3O4的质量分数为x1,其质量就是Mx1,那么其中的铅粉(Pb与PbO的混合物)的质量即为M(1-x1),两者理论上参与电极反应转移的电量之和Q就是
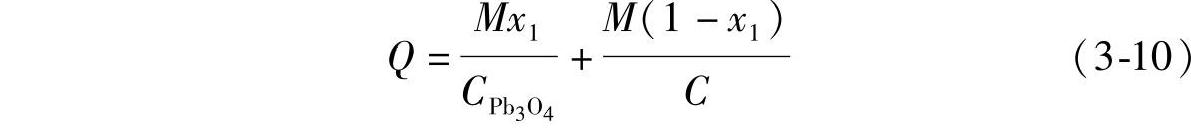
式中,CPb3O4和C分别是Pb3O4和铅粉的电化学当量。式(3-10)经整理化简变为
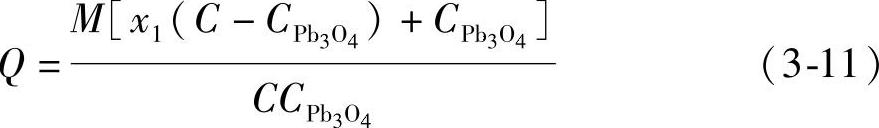 (https://www.xing528.com)
(https://www.xing528.com)
混合铅粉的总质量M与理论上电量之和Q之比就是混合铅粉的电化学当量C1,得到
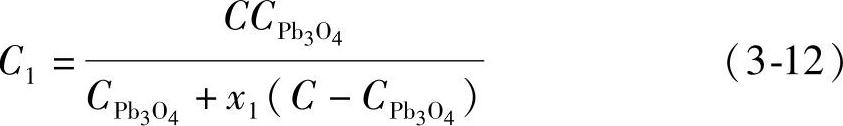
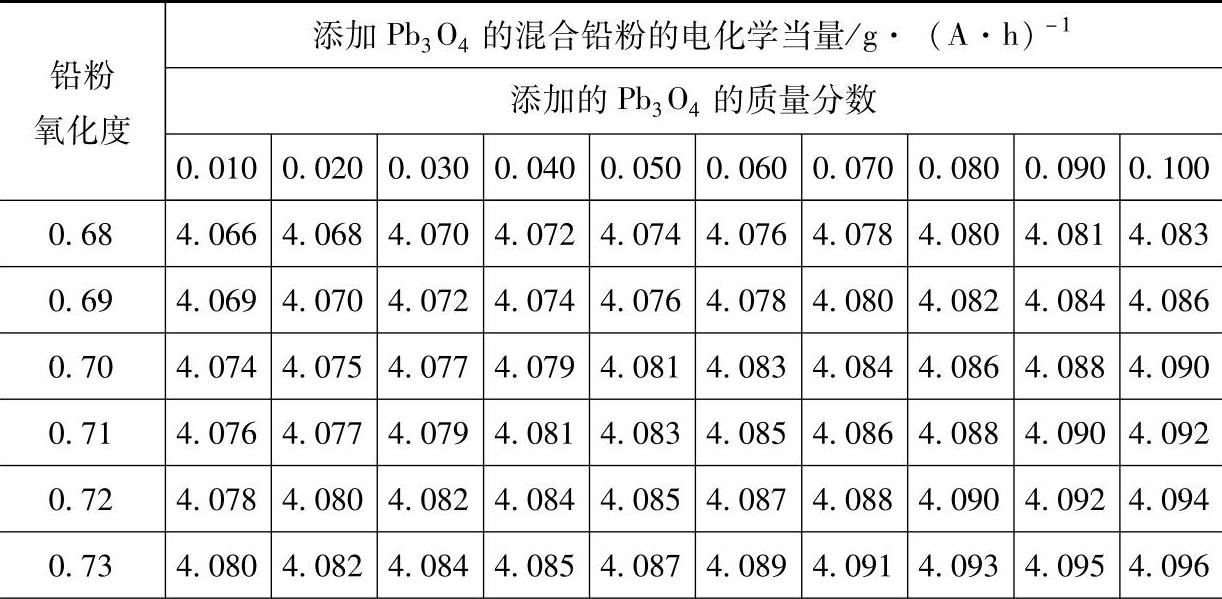
如前所述,铅粉的电化学当量C依赖于其氧化度,所以表3-10列出的是不同氧化度(即不同电化学当量)的铅粉添加不同质量分数Pb3O4的混合铅粉的电化学当量。
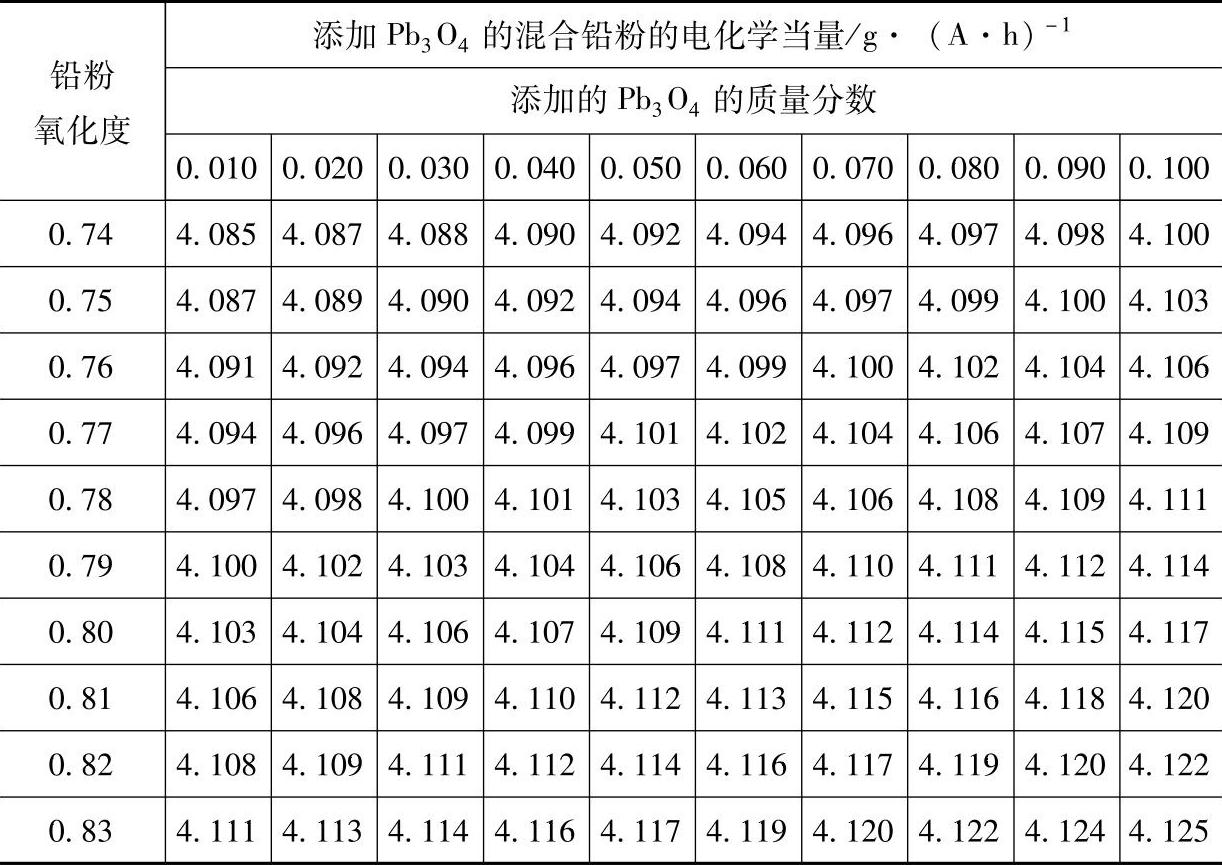
表3-10添加 Pb3O4的混合铅粉的电化学当量
(续)
添加PbO2的混合铅粉的电化学当量的计算方法是先求出PbO2的电化学当量CPbO2。在铅酸蓄电池中PbO2参与电极反应,其电化学当量CPbO2应是其摩尔质量(MPbO2=239.21g·mol-1)与2F电量之比,即
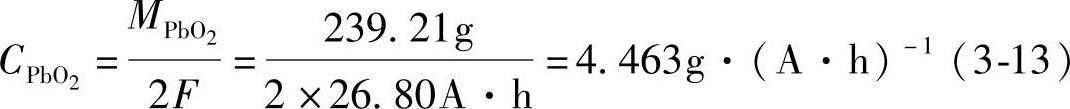
然后再来计算添加PbO2的混合铅粉的电化学当量。
假定总质量为M的混合铅粉中含有的PbO2的质量分数为x2,其质量就是Mx2,那么其中的铅粉(Pb与PbO的混合物)的质量即为M(1-x2),两者理论上参与电极反应转移的电量之和Q就是
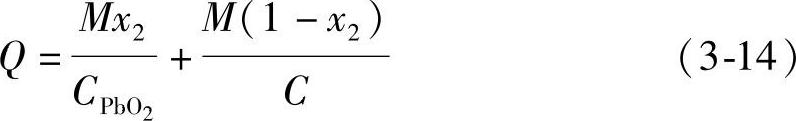
式中,CPbO2和C分别是PbO2和铅粉的电化学当量。式(3-14)经整理化简变为
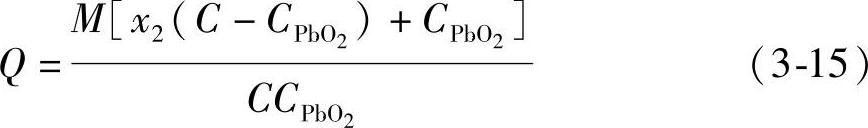
混合铅粉的总质量M与理论上电量之和Q之比就是混合铅粉的电化学当量C2,得到
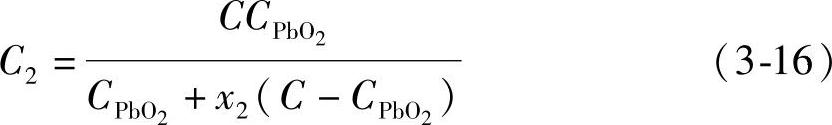
根据式(3-16)计算出来混合铅粉的电化学当量见表3-11。因为铅粉的电化学当量C依赖于其氧化度,为方便查看,表左边列出的是铅粉的氧化度值而不是其电化学当量值。
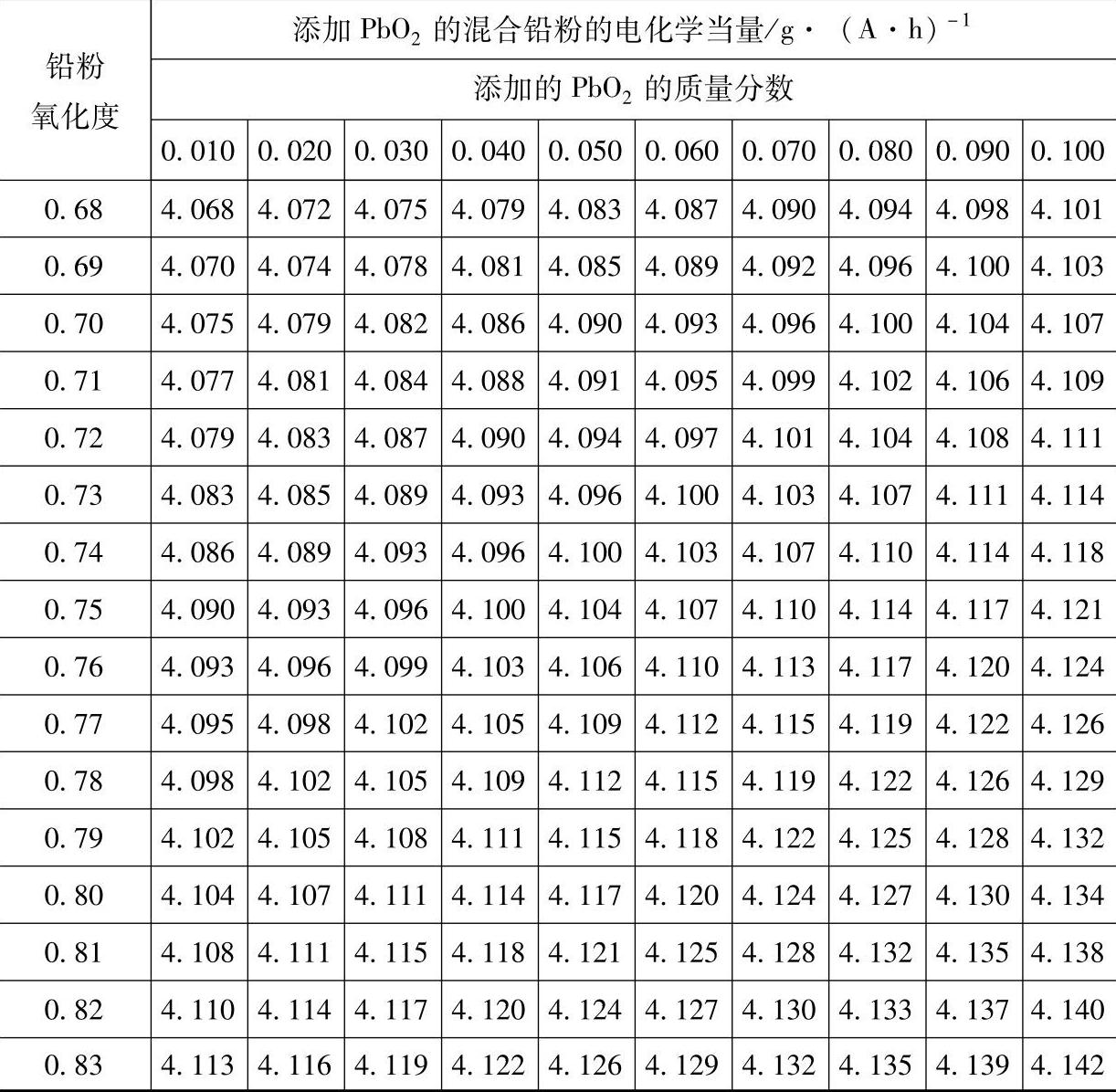
表3-11 添加PbO2的混合铅粉的电化学电量
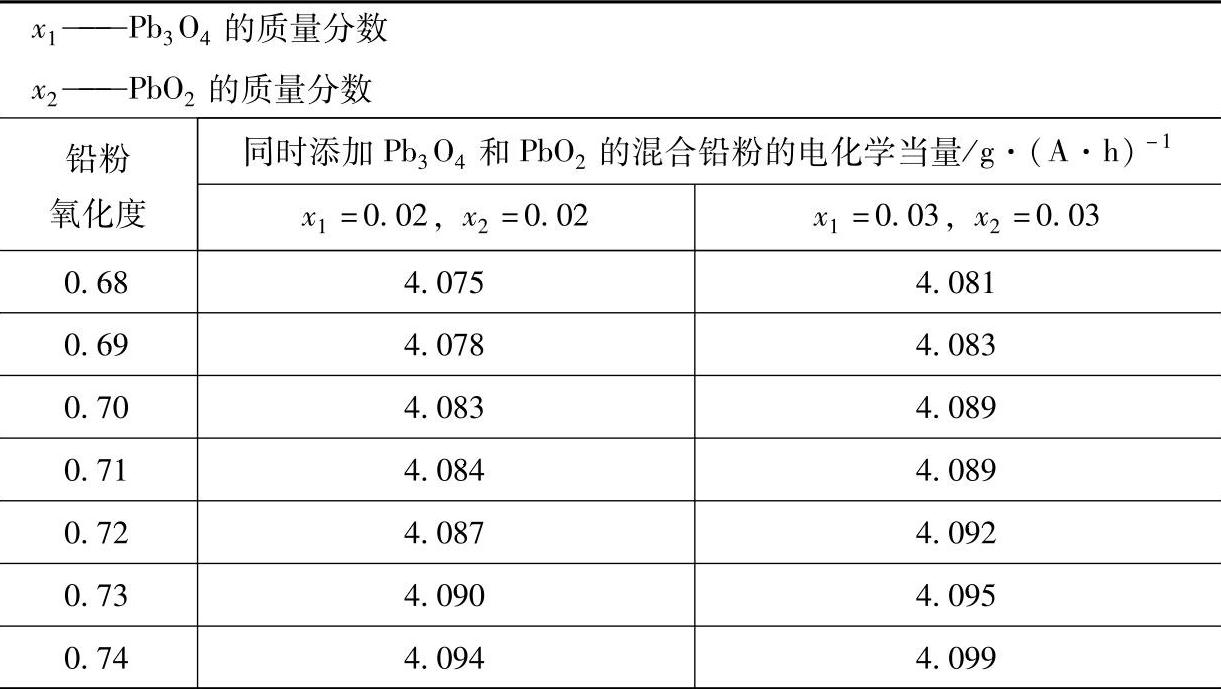
如果铅粉中同时添加有Pb3O4和PbO2,两者的质量分数分别为x1和x2。混合铅粉的总质量为M,那么Pb3O4的质量就是Mx1,PbO2的质量就是Mx2,铅粉的质量就是M(1-x1-x2)。三者参与电极反应转移的电量之和Q就是
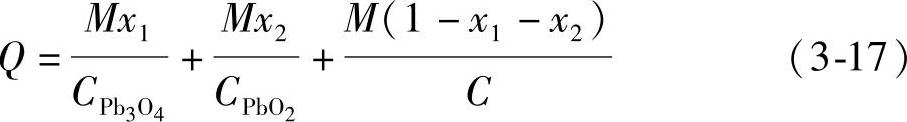
经过整理化简,式(3-17)变为
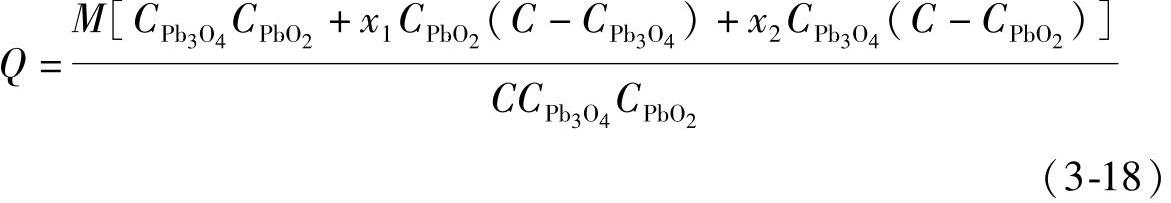
混合铅粉的总质量M与理论上电量之和Q之比就是混合铅粉的电化学当量C3,得到
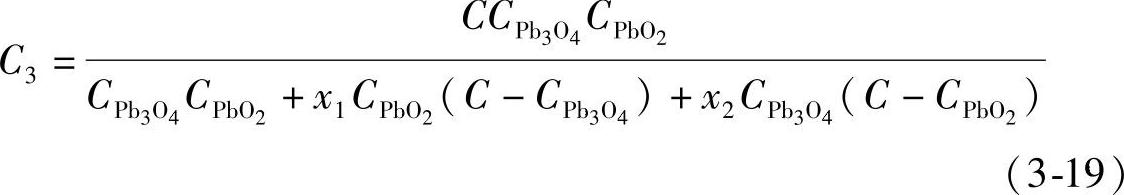
根据式(3-19)计算出来的同时添加Pb3O4和PbO2的混合铅粉的某些范围的电化学当量见表3-12。
表3-12 同时添加Pb3O4和PbO2的混合铅粉的电化学当量
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




