4.4.3.1 葡萄糖/天冬酰胺模拟非水相美拉德反应的热学分析
图4-63为相同条件下天冬酰胺热解的热分析曲线。DTG曲线出现3个明显的尖峰,说明天冬酰胺热解出现3个明显的热失重阶段,结合TG曲线可以看出出现了3个明显的平台,79~101℃为天冬酰胺第一失重区,失重为11.6%,失重率最大达476 μg/min。第二失重区为208~248℃,失重24.5%,此温度段降解最快,DTG达675 μg/min,最大吸热峰90.5 μV同样出现在这个区域,说明天冬酰胺降解需要吸收大量的热量。第三个明显的失重区为338~384℃,失重17%。根据DTG的3个尖峰,计算活化能,得到天冬酰胺在75~105℃、204~260℃和328~395℃3个温度段受热分解反应的表观活化能分别为290 kJ·mol-1、371 kJ·mol-1和735 kJ·mol-1。此外,DTA曲线显示,400℃以前有一系列的吸热峰,400℃以后变为放热峰。
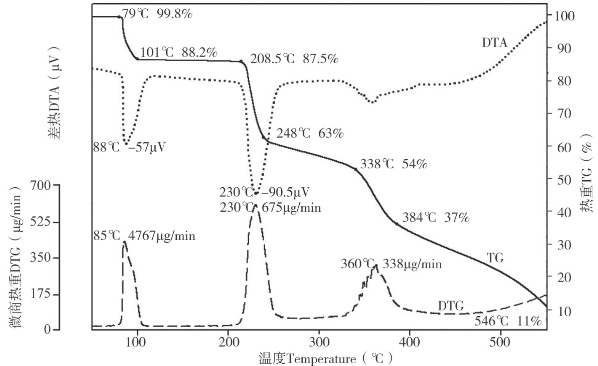
图4-63 天冬酰胺热解的热重(TG)、微商热重(DTG)、差热(DTA)-温度(℃)曲线
葡萄糖热解的热重(TG)、微商热重(DTG)、差热(DTA)-温度(℃)曲线见图4-57。

图4-64 葡萄糖/天冬酰胺混合物热解的热重(TG)、微商热重(DTG)、差热(DTA)-温度(℃)曲线
图4-64是葡萄糖、天冬酰胺按照质量比为1︰1混合均匀后的热重(TG)、微商热重(DTG)、差热(DTA)-温度(℃)曲线。由图4-64可见,葡萄糖与天冬酰胺混合后熔融峰消失,表明葡萄糖与天冬酰胺发生了反应。DTG曲线上出现了四个尖峰,说明混合物的反应热解过程经历了4个强烈热失重阶段。第一失重阶段发生在50~78℃,失重2%,失去的可能是混合物中的结晶水。第二失重阶段在78~110℃,失重8%,最大吸热峰出现在这个区域,峰值达42 μV。无论是第一失重阶段或是第二失重阶段,失重的起始温度都低于葡萄糖和天冬酰胺各自第一失重点的温度,分别为200℃和80℃。这说明混合物之间发生了反应,并且反应在较低的温度点就开始进行了。110~190℃为混合物的第三失重阶段,此温度段降解最快,DTG达最大值为514 μg/min,此阶段失重22%。190~250℃为第四失重区,失重16%。而后的250~500℃为混合物缓慢的失重区,DTG维持在120 μg/min左右,500℃时剩余质量仅为原先的4%。根据DTG曲线上的四个尖峰,同样按照MUSE软件中的Freeman-Carroll方法计算活化能。在50~78℃、80~110℃、125~190℃和200~250℃,体系受热分解反应的表观活化能分别为220 kJ·mol-1、298 kJ·mol-1、502 kJ·mol-1和392 kJ·mol-1。第一阶段失重对应温度段的降解活化能与葡萄糖、天冬酰胺各自的降解活化能418.4 kJ·mol-1、290 kJ·mol-1比较也明显偏低。这说明葡萄糖/天冬酰胺模拟非水相美拉德反应体系的热力学性质相比于单独的还原糖和氨基酸的热力学性质发生了明显的变化,葡萄糖与天冬酰胺结合形成美拉德反应的第一步中间产物——Amadori化合物的降解在较低的温度点就开始发生了,降解活化能也低于葡萄糖、天冬酰胺单独降解的活化能。从DTA曲线上可以看出,美拉德反应初期为一个吸热过程,反应的发生需要吸收一定的热量,因此反应对温度或固定温度条件下的加热时间有相关性,这和水相中美拉德反应对温度、加热时间有依赖性是一致的,并且每个DTG尖峰都对应着一个强烈的吸热峰,这说明混合物反应需要吸收热量,产生一系列的挥发性物质。
4.4.3.2 葡萄糖/天冬酰胺模拟非水相美拉德反应热解研究
为了揭示葡萄糖/天冬酰胺模拟非水相美拉德反应体系热解过程中逸出产物的变化情况,保证获取最大失重段的逸出气体组分并能满足取样温度的连续性和各温度段热解信息的可比性,针对图4-64中4个强烈的失重阶段,按照温度的连续变化而设计了划分温度段连续取样法,即将样品温度作为每次SPME取样开始和结束的信号。由于热分析仪从50℃开始升温,从混合物TG曲线可以看出50~78℃失重2%左右可能是葡萄糖或天冬酰胺吸附的部分结晶水,将第一和第二失重阶段合并一次取样。而400℃以上为混合物的碳化过程,所以取样至400℃结束。这样整个反应的热解逸出气体分为5个温度段进行连续取样,分别为:50~110℃、110~190℃、190~250℃、250~330℃和330~400℃。采用划分温度段连续取样方法,通过一次热重实验就可以收集到葡萄糖/天冬酰胺模拟非水相美拉德反应体系热解过程的逸出产物,之后利用GC/MS进样来分析产物信息。
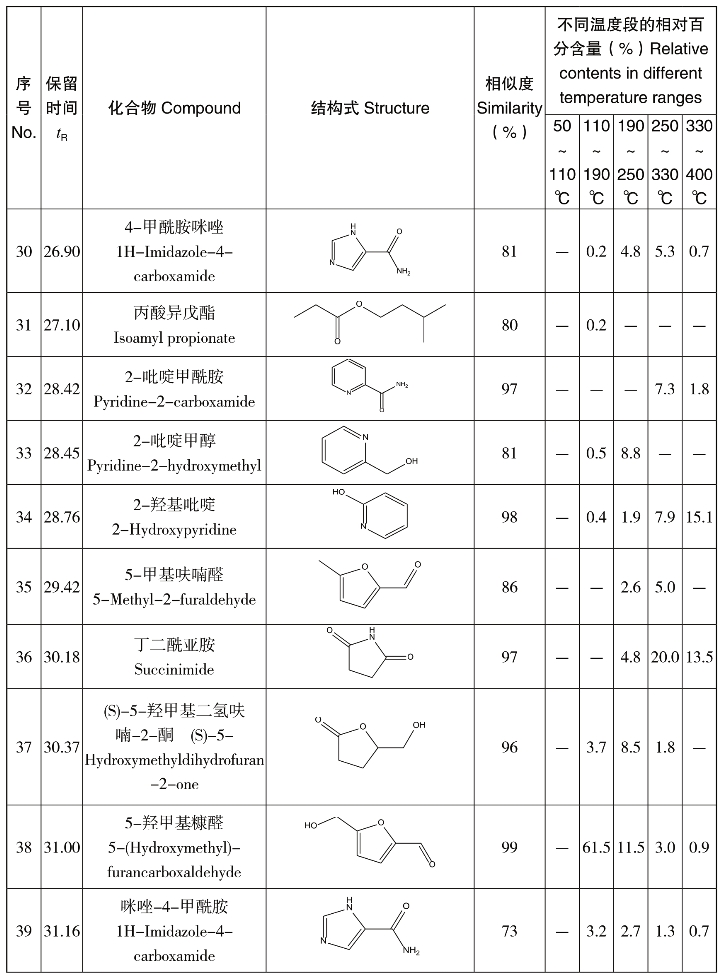
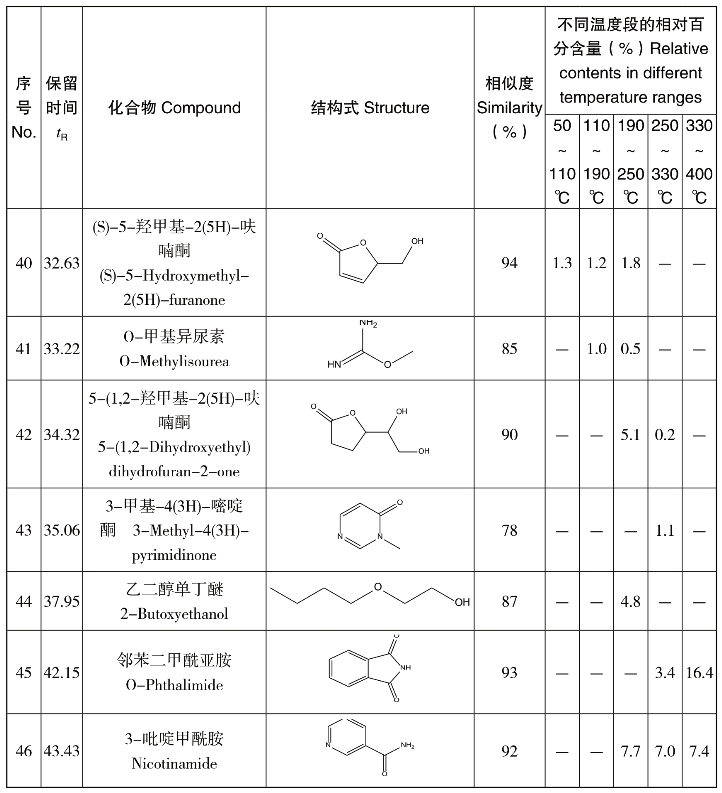
图4-65为GC-MS获得的逸出产物的总离子流色谱图,图中对比了葡萄糖/天冬酰胺混合物逸出产物的连续变化情况。图中随温度升高而变化较为明显的色谱峰共有46个,其定性结果列于表4-22中。相对百分含量值为该温度段某一产物占总峰面积的百分含量,不同温度段的数值并不能反应产物在不同温度段的升高或降低情况。由于110~190℃温度段38号峰的峰面积较大,10~28 min的色谱图单独在该区域用小框绘制如图4-65所示。结合图4-65和表4-22可以看出,反应产物的种类随着温度升高而变化。在较低温度段,产物主要为长链的烷烃、醚和酮类物质。这是因为葡萄糖和天冬酰胺在低温发生开环、脱水和缩合反应。在110~190℃,大量的5-羟甲基糠醛生成,这是葡萄糖和天冬酰胺缩合形成的氨基糖经Amadori重排得到的中间产物环化生成,是美拉德反应的特征产物。此外Amadori重排产物可以脱氨形成还原酮或脱氢还原酮,在此温度段也检测出相应多种酮类物质。这些酮类在高温阶段又环化和裂解成各种化合物,此过程中包括了醛醇缩合,醛、氨基聚合以及吡啶、咪唑等含N杂环化合物的生成。对应表4-22可以看出,200~400℃的高温段,吡啶、咪唑等含N杂环类化合物被检测出。110~190℃还有一个重要的产物是丙烯酰胺,在此温度段的相对百分含量为0.8,在其他温度段均未检测到。这说明葡萄糖和天冬酰胺在非水相条件下也能发生美拉德反应生成丙烯酰胺,而且生成温度为110~190℃。
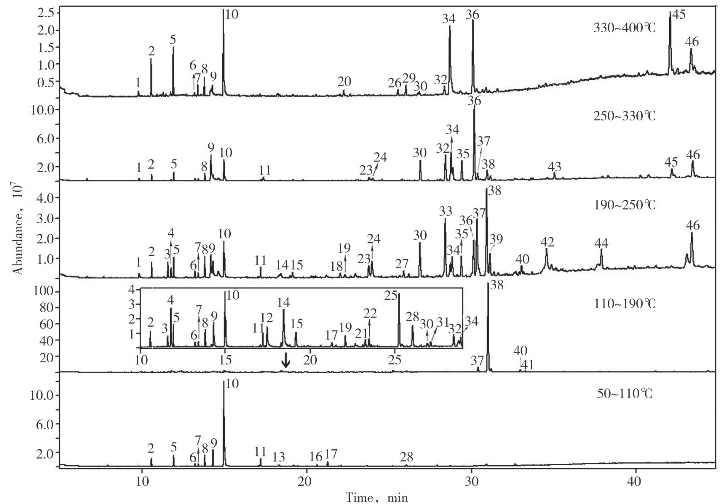
图4-65 葡萄糖/天冬酰胺混合物不同温度段热解逸出产物的总离子流色谱图对比
表4-22 葡萄糖/天冬酰胺混合物热解逸出产物的GC-MS分析结果
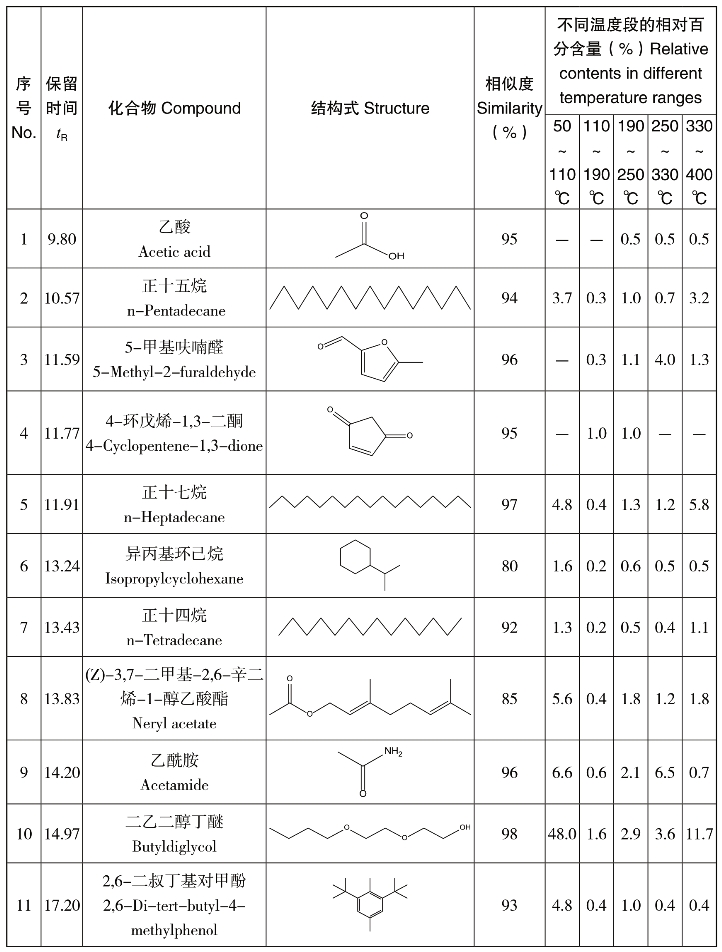 (https://www.xing528.com)
(https://www.xing528.com)
续表
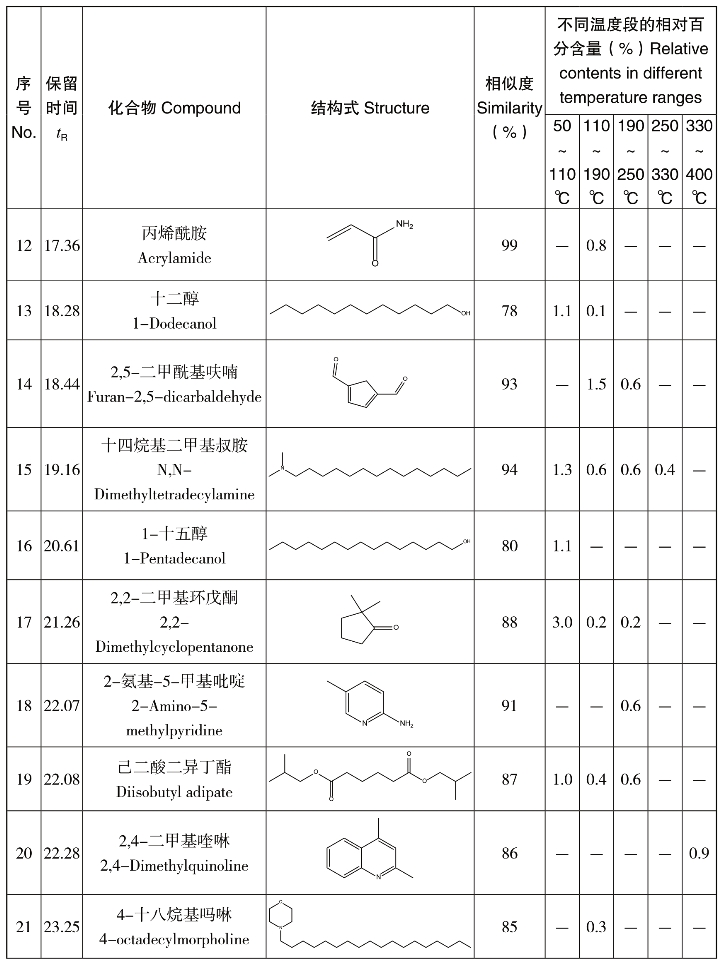
续表

续表
续表
4.4.3.3 维生素C和阿魏酸对葡萄糖/天冬酰胺美拉德反应产生丙烯酰胺的影响研究
由于丙烯酰胺能导致哺乳动物细胞基因变异和染色体异常,具有致癌性[91],所以人们希望尽量避免丙烯酰胺生成。目前,降低丙烯酰胺生成的方法主要有:第一,尽量避免过高温度和长时间的热加工,如采用真空低温油炸。第二,对一些天冬酰胺含量高的食品原料,采用天冬酰胺酶或用酸将天冬酰胺降解成天冬氨酸。第三,加工时添加一些抗氧化剂阻止丙烯醛形成丙烯酸。但是,真空油炸不易推广,酶分子很难渗透到食品材料内部,酸水解需要较高的酸浓度,而采用添加剂的方法是相对简单方便的。分别将质量比为1︰1︰1的葡萄糖/天冬酰胺/维生素C和质量比为1︰1︰1的葡萄糖/天冬酰胺/阿魏酸混合物细致研磨、混合均匀后按上述实验条件进行非水相美拉德反应,并将逸出产物用SPME萃取后进行GC-MS分析,与未加添加剂时模拟体系生成丙烯酰胺的峰面积进行比较,结果如表4-23。由表可以看出,添加维生素C和阿魏酸后,葡萄糖和天冬酰胺发生美拉德反应生成丙烯酰胺的量明显减少,抑制率分别为28.5%和13.8%,且加入维生素C的抑制率大于加入阿魏酸的。这说明在葡萄糖/天冬酰胺模拟非水相美拉德反应的体系中添加维生素C和阿魏酸是降低丙烯酰胺的有效途径,并且进一步验证了利用热重-固相微萃取-气相色谱-质谱(TG-SPME-GC-MS)联用研究葡萄糖/天冬酰胺模拟非水相美拉德反应体系,方法可靠,简单易行。
表4-23 维生素C和阿魏酸对非水相美拉德反应体系丙烯酰胺产生的影响

注:抑制率(%)=(空白丙烯酰胺峰面积-添加Vc/阿魏酸后丙烯酰胺峰面积)/空白丙烯酰胺峰面积×100%
4.4.3.4 结论
采用热重-固相微萃取-气相色谱-质谱联用研究葡萄糖/天冬酰胺模拟非水相美拉德反应体系,对反应的热学性质和逸出组分进行表征。结果表明:第一,葡萄糖/天冬酰胺模拟非水相美拉德反应体系的热解过程经历了四个强烈热失重阶段,并且每个失重段都对应着一个强烈的吸热峰,这说明混合物反应需要吸收热量,产生一系列的挥发性物质。第二,葡萄糖/天冬酰胺混合物的降解活化能低于葡萄糖、天冬酰胺单独降解的活化能。第三,美拉德反应产物检出的色谱峰共有46个,其种类和含量随着温度的变化而变化,低温段生成物以长链烷烃、酮类、糠醛类为主;高温段产物主要为吡啶、吡咯、咪唑等含N杂环化合物。第四,葡萄糖/天冬酰胺模拟体系中添加维生素C和阿魏酸是降低丙烯酰胺的有效途径,并且添加维生素C减少的丙烯酰胺量大于添加阿魏酸的。本实验分析了空气氛围中温度连续上升模式下的葡萄糖/天冬酰胺模拟非水相美拉德反应体系,为食品和卷烟美拉德反应香料的热解行为和机理研究提供了一种简便可靠的分析方法,对进一步补充、证实和完善美拉德反应理论体系具有参考价值。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




