蛋白质的凝胶作用同蛋白质的缔合、凝集、聚合、沉淀、絮凝和凝结等分散性的降低是不同的。蛋白质的缔合一般是指亚基或分子水平上发生的变化;聚合或凝集一般是指较大复合物的形成;沉淀作用指由于溶解度全部或部分丧失而引起的一切凝集反应;絮凝是指没有变性时的无序凝集反应,这种现象常常是因为链间静电排斥力的降低而引起的;凝结作用是指发生变性的无规则聚集反应和蛋白质-蛋白质的相互作用大于蛋白质-溶剂的相互作用引起的凝集反应。变性的蛋白质分子聚集并形成有序的蛋白质网络结构的过程称为凝胶作用。
食品蛋白凝胶大致可分为以下几类:①加热后冷却产生的凝胶,这种凝胶多为热可逆凝胶,如明胶溶液加热后冷却形成的凝胶;②加热状态下产生凝胶,这种凝胶很多是不透明而且非可逆凝胶,如蛋清蛋白在煮蛋中形成的凝胶;③由钙盐等二价金属盐形成的凝胶,例如大豆蛋白质形成豆腐;④不加热而经部分水解或pH调整到等电点而产生凝胶,例如凝乳酶制作干酪、乳酸发酵制作酸奶和皮蛋等生产中的碱对蛋清蛋白的部分水解等。
大多数情况下,热处理是凝胶作用所必需的条件,然后必须冷却,略微酸化也是有利的。增加盐类,尤其是钙离子也可以提高凝胶速率和凝胶强度(大豆蛋白、乳清蛋白和血清蛋白)。但是,某些蛋白质不加热也可凝胶,而仅仅需经适当的酶解(酪蛋白胶束、卵白和血纤维蛋白),或者只是单纯地加入钙离子(酪蛋白胶束),或者在碱化后使其恢复到中性或等电点pH(大豆蛋白)。虽然许多凝胶是由蛋白质溶液形成的(鸡卵清蛋白和其他卵清蛋白等),但不溶或难溶性的蛋白质水溶液或盐水分散液也可以形成凝胶(胶原蛋白、肌原纤维蛋白)。因此,蛋白质的溶解性并不是凝胶作用必需的条件。
一般认为蛋白质凝胶网络的形成是由于蛋白质-蛋白质、蛋白质-溶剂(水)的相互作用,邻近肽链之间的吸引力和排斥力达到平衡时引起的。疏水作用力、静电相互作用、氢键和二硫键等对凝胶形成的相对贡献随蛋白质的性质、环境条件和凝胶过程中步骤的不同而异。静电排斥力和蛋白质-水之间的相互作用有利于肽链的分离。蛋白质浓度高时,因分子间接触的概率增大,更容易产生蛋白质分子间的吸引力和胶凝作用。蛋白质溶液浓度高时即使环境条件对凝集作用并不十分有利(如不加热、pH与等电点相差很大时),也仍然可以发生凝胶作用。共价二硫交联键的形成通常会导致热不可逆凝胶的生成,如卵清蛋白和β-乳球蛋白凝胶。而明胶则主要通过氢键的形成而保持稳定,加热时(约30℃)熔融,并且这种凝结—熔融可反复循环多次而不失去凝胶特性。
将种类不同的蛋白质放在一起加热可产生共凝胶作用而形成凝胶,而且蛋白质还能与多糖凝胶剂相互作用而形成凝胶,带正电荷的明胶与带负电荷的海藻酸盐或果胶酸盐之间通过非特异性离子间的相互作用能生成高熔点(80℃)的凝胶。同样,在牛奶的等电点时,酪蛋白胶束能够存在于卡拉胶的凝胶中。(https://www.xing528.com)
许多凝胶以一种高度膨胀(敞开)的水合结构的形式存在。每克蛋白质约可含水10g以上,而且食品中的其他成分可被截留在蛋白质的网络之中。有些蛋白质凝胶甚至可含98%的水,这是一种物理截留水,不易被挤压出来。曾有人对凝胶具有很大持水容量的能力作出假设,认为这可能是二级结构在热变性后,肽链上未被掩盖的肽链的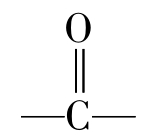 和—NH基的各自成为负的和正的极化中心,因而可能建立一个广泛的渗层水体系。冷却时,这种蛋白质通过重新形成的氢键而相互作用,并提供固定自由水所必需的结构。也可能是蛋白质网络的微孔通过毛细管作用来保持水分。
和—NH基的各自成为负的和正的极化中心,因而可能建立一个广泛的渗层水体系。冷却时,这种蛋白质通过重新形成的氢键而相互作用,并提供固定自由水所必需的结构。也可能是蛋白质网络的微孔通过毛细管作用来保持水分。
凝胶的生成是否均匀,这和凝胶生成的速度有关。如果条件控制不当,使蛋白质在局部相互结合过快,凝胶就较粗糙不匀。凝胶的透明度与形成凝胶的蛋白质颗粒的大小有关,如果蛋白质颗粒或分子的表观分子质量大,形成的凝胶就较不透明。同时蛋白质凝胶强度的平方根与蛋白质相对分子质量之间呈线性关系。
许多凝胶以一种高度膨胀(敞开)的水合结构的形式存在。每克蛋白质约可含水10g以上,而且食品中的其他成分可被截留在蛋白质的网络之中。有些蛋白质凝胶甚至可含98%的水,这是一种物理截留水,不易被挤压出来。曾有人对凝胶具有很大持水容量的能力作出假设,认为这可能是二级结构在热变性后,肽链上未被掩盖的肽链的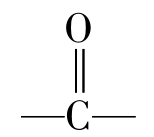 和—NH基的各自成为负的和正的极化中心,因而可能建立一个广泛的渗层水体系。冷却时,这种蛋白质通过重新形成的氢键而相互作用,并提供固定自由水所必需的结构。也可能是蛋白质网络的微孔通过毛细管作用来保持水分。
和—NH基的各自成为负的和正的极化中心,因而可能建立一个广泛的渗层水体系。冷却时,这种蛋白质通过重新形成的氢键而相互作用,并提供固定自由水所必需的结构。也可能是蛋白质网络的微孔通过毛细管作用来保持水分。
凝胶的生成是否均匀,这和凝胶生成的速度有关。如果条件控制不当,使蛋白质在局部相互结合过快,凝胶就较粗糙不匀。凝胶的透明度与形成凝胶的蛋白质颗粒的大小有关,如果蛋白质颗粒或分子的表观分子质量大,形成的凝胶就较不透明。同时蛋白质凝胶强度的平方根与蛋白质相对分子质量之间呈线性关系。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




