1.原理
将饮料中钾、总磷、氨基酸态氮、L-脯氨酸、总D-异柠檬酸、总黄酮6种组分的实测值与各自标准值的比值合理修正后,乘以相应的修正权值,逐项相加求得样品中果汁的含量。
(1)标准值 标准值是指根据不同品种、不同产区、不同采收期、不同加工工艺、不同储存期的果汁及其浓缩汁复原的果汁中可溶性固形物含量,以及钾、总磷、氨基酸态氮、L-脯氨酸、总D-异柠檬酸、总黄酮6种组分实测值的分布状态,经数理统计确定的平均值。
(2)权值 权值是指根据不同产区和不同品种水果中钾、总磷、氨基酸态氮、L-脯氨酸、总D-异柠檬酸、总黄酮6种组分实测值变异系数的大小而确定的某种组分在总体中所占的比例。
(3)可溶性固形物的标准值 水果原汁可溶性固形物(加糖除外)的标准值(20℃折光计法)以20%计。6种组分的标准值和权值见表3-2-11。
表3-2-11 6种组分的标准值和权值
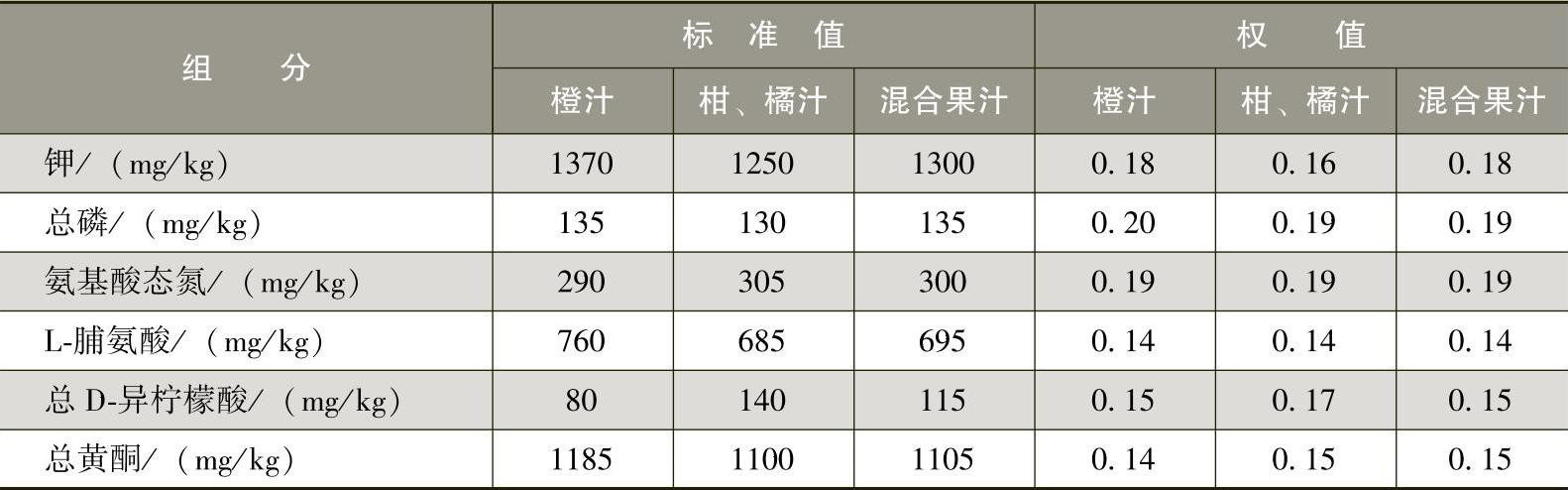
注:若标签上未标明橙、桔或柑汁,则以混合果汁计算。
2.仪器与试剂
(1)仪器 原子吸收分光光度计(带钾空心阴极灯)、紫外分光光度计(带1cm石英比色皿)、可见分光光度计(带1cm比色皿)、pH计(带pH玻璃电极和饱和甘汞电极,精度为0.1pH单位)、电磁搅拌器、玻璃电极和甘汞电极、天平(感量为10mg)、分析天平(感量为0.1mg)、微量可调移液管(0~1000mL)、凯氏烧瓶(500mL)、离心机(转速不低于4000r/min,带10mL离心管和容积大于80mL的离心管)、微量可调移液管(10~50μL,允许误差为±4.8%)。
(2)试剂 硝酸、硫酸、甲醛(体积分数为36%)、0.05mol/L氢氧化钠标准溶液、乙酸乙酯、甲酸、氨水、丙酮。其他试剂如下:
1)10g/L氯化钠溶液:称取1.0g氯化钠,加水溶解后定容至100mL。
2)体积分数为10%的硝酸溶液:量取1体积硝酸,注入9体积水中。
3)体积分数为50%的盐酸溶液:量取1体积盐酸,注入1体积水中。
4)体积分数为10%的硫酸溶液:量取1体积硫酸,缓慢注入9体积水中。
5)中性甲醛溶液:在使用前1h量取200mL甲醛溶液置于400mL烧杯中,然后将烧杯置于电磁搅拌器上,边搅拌边用0.1mol/L氢氧化钠溶液调至pH=8.4。
6)0.1mol/L氢氧化钠标准溶液:用感量为0.1g的天平,迅速称取分析纯氢氧化钠4g,溶于蒸馏水中稀释到1000mL,摇匀并标定。
7)0.05mol/L氢氧化钠标准溶液:用0.1mol/L的氢氧化钠标准溶液当天稀释。
8)pH=6.88的缓冲溶液:用磷酸盐标准物质直接配制。
9)钒-钼酸铵溶液:称取20.0g钼酸铵,溶解在体积约400mL、温度为50℃的热水中,冷却;称取1.0g偏钒酸铵,溶解在300mL、温度为50℃的热水中,冷却;边搅拌边加入1mL硫酸,将钼酸铵溶液缓慢加到偏钒酸铵溶液中,搅拌均匀后,转移至1000mL容量瓶中,用水定容至刻度。
10)100mg/L磷标准溶液:准确称取0.4394g经105℃±2℃干燥2h的磷酸二氢钾,置于50mL烧杯中,加水溶解,转移至1000mL容量瓶中,用水定容至刻度,摇匀。
11)无过氧化物乙二醇独甲醚的制备:将数粒锌粒放入乙二醇独甲醚中,在暗处放置2天。
12)3.0g/L茚三酮与二醇独甲醚溶液:称取3.0g水合茚三酮,溶解在100mL无过氧化物的乙二醇独甲醚溶液中,储存在棕色瓶中,置于避光处。此溶液易被氧化,应每周制备一次。
13)L-脯氨酸标准储备液(500mg/L):精确称取0.0500gL-脯氨酸,置于50mL烧杯中,加水溶解,转移至100mL棕色容量瓶中,用水定容至刻度,摇匀,储存在温度约为4℃的冰箱内。
14)组合试剂盒
1号瓶:内含咪唑缓冲液(稳定性)30mL,pH=7.1。
2号瓶:内含β-烟酰胺-腺嘌呤-双核苷酸-磷酸二钠45mg、硫酸锰10mg。
3号瓶:内含异柠檬酸脱氢酶2mg,5(U)个活力单位。
15)NADP溶液:将1号瓶内的溶液升温至20~25℃,倒入2号瓶中,使2号瓶中的物质全部溶解,混合均匀。
16)异柠檬酸脱氢酶溶液:用1.8mL水溶解3号瓶的物质,混合均匀。
17)3mol/L氢氧化钠溶液:称取16g氢氧化钠,加水溶解,定容至100mL
18)4mol/L盐酸溶液:量取33.4mL盐酸,用水定容至100mL。
19)300g/L氯化钡溶液:称取30g氯化钡,溶解在热水中,冷却后定容至100mL。
20)71g/L硫酸钠溶液:称取71g无水硫酸钠,溶解于水中,定容至1000mL。
21)缓冲溶液:称取2.4g三羟甲基氨甲烷和0.035g乙二胺四乙酸二钠,用80mL水溶解,先用4mol/L氢氧化钠溶液调至pH值为7.2左右,再用1mol/L盐酸溶液调至pH值为7.0(用pH计测定),用水定容至100mL。
22)洗涤溶液:量取150mL水,加入10mL氨水、100mL丙酮,混匀。
23)200g/L柠檬酸溶液:称取20g柠檬酸,加水溶解,定容至100mL。
24)乙醇溶液:体积分数为60%。
25)10g/L氢氧化钠溶液:称取10.0g氢氧化钠,加水溶解,定容至1L。
26)50g/L亚硝酸钠溶液:称取5.0g亚硝酸钠,加水溶解,定容至100mL。
27)100g/L硝酸铝溶液:称取10.0g硝酸铝,加水溶解,定容至100mL。
28)200g/L氢氧化钠溶液:称取20.0g氢氧化钠,加水溶解,定容至100mL。
29)2.00mg/mL芦丁标准储备液:称取0.2000g芦丁(精确至0.0002g)经120℃减压干燥到恒重的无水芦丁(已知质量分数大于99.0%),置于100mL容量瓶中,用乙醇溶液溶解并定容至刻度,摇匀。
30)0.20mg/mL芦丁标准使用液:吸取10.00mL芦丁标准储备液置于100mL容量瓶中,用水定容至刻度,临用时现配。
31)200mg/L橙皮苷标准溶液:精确称取0.0250g橙皮苷(质量分数约为80%)置于50mL烧杯中,加20mL0.1mol/L氢氧化钠溶液,用200g/L柠檬酸溶液调至pH=6,转移至100mL容量瓶中,用水定容至刻度,摇匀。溶液中橙皮苷的含量为200mg/L。此标准溶液需当日配制。
3.操作步骤
(1)钾的测定 同本节技能训练1,结果记为x1。
(2)总磷的测定
1)原理:样品经消化后,在酸性条件下,磷酸盐与钒-钼酸铵反应呈现黄色,在波长400nm处测定溶液的吸光度,与标准系列溶液比较,确定样品中总磷的含量。
2)测定步骤
①样品溶液制备(同本节技能训练1)
②测定
a.工作曲线的绘制:吸取0.00mL、1.00mL、2.00mL、3.00mL、4.00mL、5.00mL磷标准溶液,分别置于50mL容量瓶中,各加10mL(1+9)硫酸溶液,摇匀,加10mL钒-钼酸铵溶液,用水定容至刻度,摇匀,配制成0.0mg/L、2.0mg/L、4.0mg/L、6.0mg/L、8.0mg/L、10.0mg/L磷标准系列溶液,在室温下放置10min。用1cm比色皿,以0.0mg/L磷标准溶液调节零点,在波长400nm处测定磷标准系列溶液的吸光度,以吸光度对磷含量绘制工作曲线或计算回归方程。
b.样品的测定:准确吸取5.0~10.0mL样品溶液置于50mL容量瓶中,加入(1+9)硫酸溶液至10mL,以下按上述绘制工作曲线中的方法操作。以试剂空白溶液调整零点,在波长400nm处测定吸光度,从工作曲线上查出(或用回归方程求出)样品溶液中磷的含量(c2),同时测定试剂空白消化液中磷的含量(c02)。
3)结果计算
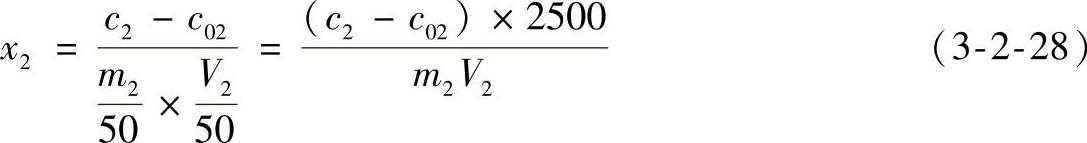
式中 x2——样品中总磷的含量(mg/kg);
c2——从工作曲线上查出(或用线性回归方程求出)样品溶液中磷的含量(mg/L);
c02——从工作曲线上查出(或用线性回归方程求出)试剂空白液中磷的含量(mg/L);
m2——样品的质量(g);
V2——测定时吸取的样品溶液的体积(mL)。
计算结果精确到小数点后第一位。同一样品的两次测定结果之差不得超过平均值的5.0%。
(3)果蔬汁饮料中氨基态氮的测定(甲醛值法)
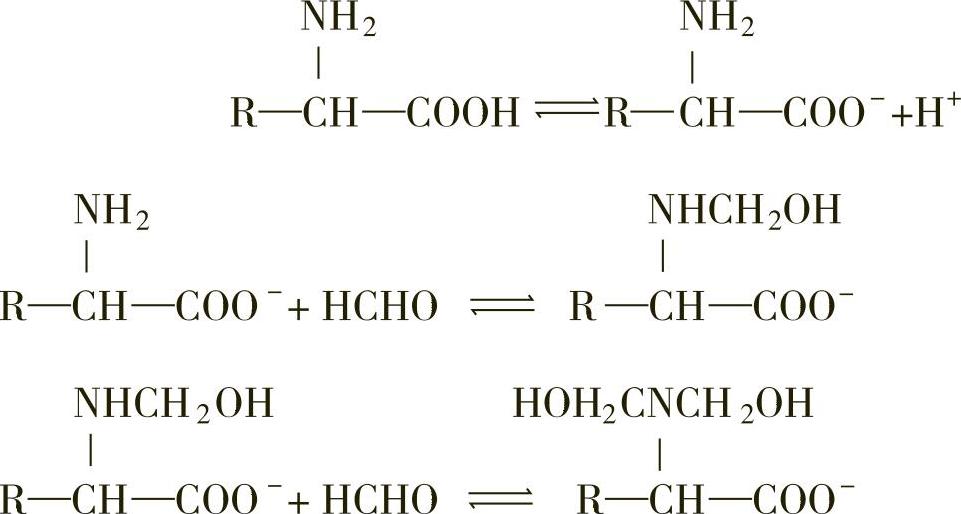
1)原理:氨基酸分子中既含有羧基,又含有氨基,为两性电解质。加入甲醛以固定氨基,使溶液显示酸性,用氢氧化钠标准溶液滴定,以酸度计测定终点,根据碱液的消耗量,计算出氨基态氮的含量。其离子反应式如下:
2)操作步骤
①试样液的制备
a.浓缩果蔬汁:在浓缩果蔬汁中加入与在浓缩过程中失去的天然水分等量的水,使其成为果汁,并充分混匀,供测试用。
b.果蔬汁及果蔬汁饮料:将试样充分混匀,直接测定。
c.含有碳酸气的果蔬汁饮料:移取500g试样,在沸水浴上加热15min,不断搅拌,使二氧化碳气体尽可能排除,冷却后,用水补充至原质量,充分混匀,供测试用。
d.果蔬汁固体饮料:移取约125g(精确至0.001g)试样,溶解于蒸馏水中,将其全部转移到250mL容量瓶中,用蒸馏水稀释至刻度,充分混匀,供测试用。
②测定。将pH计接通电源,预热30min后,用pH=6.8的缓冲溶液校正pH计,然后吸取适量试样液(氨基态氮的含量为1~5mg)置于烧杯中,加5滴30%过氧化氢,将烧杯置于电磁搅拌器上,电极插入烧杯内试样中的适当位置,若需要则加适量蒸馏水。
开动磁力搅拌器,先用0.1mol/L氢氧化钠标准溶液慢慢中和试样中的有机酸,当pH值达到7.5左右时,再用0.05mol/L氢氧化钠标准溶液调至pH=8.1,并保持1min不变,然后慢慢加入10~15mL中性甲醛溶液,1min后用0.05mol/L氢氧化钠标准溶液滴定至pH=8.1,记录消耗0.05mol/L氢氧化钠标准溶液的体积,以计算氨基酸态氮的含量。
3)结果计算。按式(3-2-29)计算氨基态氮的含量。
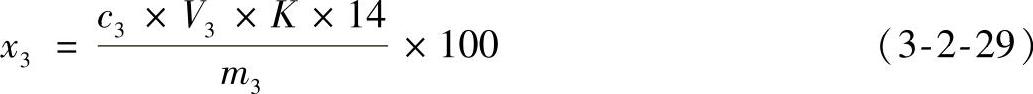
式中 x3——每100g(或100mL)试样中氨基酸态氮的含量(mg/100g或mg/100mL);
V3——加入中性甲醛溶液后,滴定试样消耗0.05mol/L氢氧化钠标准溶液的体积(mL);
c3——氢氧化钠标准溶液的浓度(mol/L);
K——稀释倍数;
14——1mL1mol/L氢氧化钠标准溶液相当于氮的毫克数(mg/mmol);
m3——试样的质量或体积(g或mL)。
4)注意事项:所用水应为经煮沸除去CO2的蒸馏水。
允许差:同一样品以两次测定结果的算术平均值作为结果,精确到小数点后第一位。同一样品的两次测定结果之差:氨基态氮含量大于或等于10mg/100g(或10mg/100mL)时,不得大于2%;氨基态氮含量小于10mg/100g(或10mg/100mL)时,不得大于5%。
(4)L-脯氨酸的测定(https://www.xing528.com)
1)原理:L-脯氨酸与水合茚三酮作用,生成黄红色配位化合物,用乙酸丁酯萃取后的配位化合物,在波长509nm处测定吸光度,与标准系列溶液比较,确定样品中L-脯氨酸的含量。
2)操作步骤
①样品溶液的制备:称取一定量混合均匀的样品(浓缩汁为1.00g,果汁为5.00g,果汁饮料和果汁型碳酸饮料为10.00~200.0g)置于200mL容量瓶中,用水定容至刻度,摇匀,备用。
②测定
a.显色:吸取0.00mL、0.50mL、1.00mL、2.50mL、4.00mL、5.00mLL-脯氨酸储备溶液分别置于50mL容量瓶中,用水定容至刻度,摇匀,配制成0.0mg/L、5.0mg/L、10.0mg/L、25.0mg/L、40.0mg/L、50.0mg/L的L-脯氨酸标准系列溶液。
吸取此标准系列溶液各1.0mL,分别置于6支25mL具塞试管中,各加1mL甲酸,充分摇匀,加2mL茚三酮乙二醇独甲醚溶液,摇匀。将6支试管同时置于1000mL烧杯的沸水浴中(水浴液面应高于试管液面),待烧杯中的水沸腾后,精确计时15min,同时取出6支试管,置于20~22℃水浴中冷却10min。
b.萃取、测定吸光度:在上述6支试管中各加10.0mL乙酸乙酯,盖塞,充分摇匀,将红色配位化合物萃取到乙酸乙酯层中,静置数分钟,将试管中的乙酸丁酯溶液分别倒入10mL具塞离心管中,盖塞,以2500r/min的转速离心5min。
将上层清液小心地倒入1cm比色皿中,以试剂空白溶液调节零点,在波长509nm处测定各上层清液的吸光度,以吸光度为纵坐标,L-脯氨酸的含量为横坐标,绘制工作曲线或计算回归方程。
c.试液的测定:吸取1.0mL样品溶液置于25mL具塞试管中,以下按上述绘制工作曲线的步骤操作,从工作曲线上查出(或用回归方程计算出)样品溶液中L-脯氨酸的含量(c4)。
3)结果计算
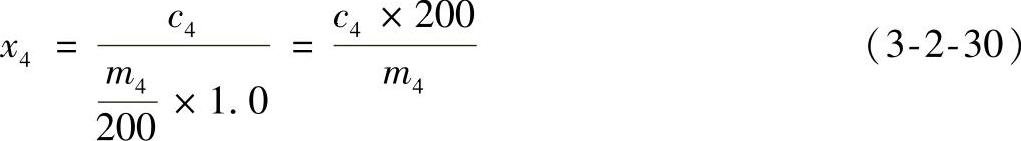
式中 x4——样品中L-脯氨酸的含量(mg/kg);
c4——从工作曲线上查出(或用回归方程求出)样品溶液中L-脯氨酸的含量(mg/L);
m4——样品的质量(g)。
计算结果精确到小数点后第一位。同一样品的两次测定结果之差不得超过平均值的5.0%。
(5)总D-异柠檬酸的测定
1)原理:在异柠檬酸脱氢酶(ICDH)的催化下,样品中的D-异柠檬酸盐与烟酰胺-腺嘌呤-双核苷酸磷酸(NADP)作用,生成NADPH的含量相当于D-异柠檬酸盐的量。在波长340nm处测定吸光度,确定样品中总D-异柠檬酸的含量。

2)操作步骤
①样品溶液的制备
a.果汁型碳酸饮料:称取500mL样品置于1000mL烧杯中,加热煮沸,在微沸状态下保持5min,并不断搅拌,待二氧化碳基本除净后,冷却至室温,称量。用水补足至加热前的质量,备用。
b.浓缩果汁、果汁、果汁饮料、水果饮料:混匀后备用。
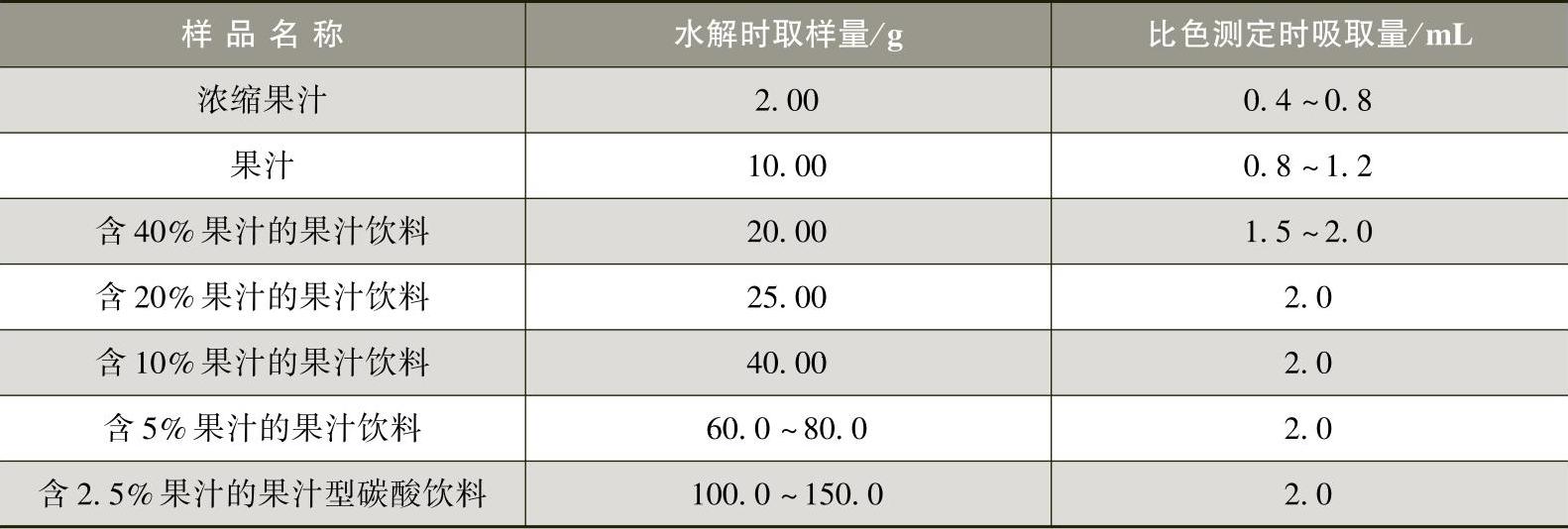
②水解:按表3-2-12中规定的取样量称取样品溶液进行水解。
a.浓缩汁、果汁:称取样品溶液置于50mL烧杯中,加5mL4mol/L氢氧化钠溶液,搅拌均匀,在室温下放置10min,使之水解。将溶液移入离心管中,用5mL4mol/L盐酸溶液和10~20mL水分数次洗涤烧杯,将洗液并入离心管中,使总体积约为30mL,搅拌均匀。
b.果汁饮料、水果饮料、果汁型碳酸饮料:称取样品溶液置于离心管中,加5mL4mol/L氢氧化钠溶液,搅拌均匀,在室温下放置10min,使之水解,加5mL4mol/L盐酸溶液,搅拌均匀。
表3-2-12 水解时取样量和比色测定时吸取量
③沉淀
a.称样量小于或等于25g的样品试液:在盛有水解物的离心管中依次加入2mL氨水、3mL氯化钡(300g/L)、20mL丙酮,用玻璃棒搅拌均匀,取出玻璃棒,按顺序放在棒架上。将离心管在室温(约20℃)放置10min,以3000r/min转速离心5~10min,小心倾去上层溶液,保留离心管底部沉淀物。
b.称样量大于25g的样品溶液:按上述步骤分别制备2~6份沉淀物,然后用约50mL洗涤溶液将2支(或3支、4支、6支,视称样量而定)离心管中的沉淀物合并到1支离心管中,在室温(约20℃)放置10min,以3000r/min的转速离心5~10min,小心倾去上层溶液,保留离心管底部沉淀物。
④溶解:将玻璃棒按顺序放回原离心管中,向离心管中加入20mL71g/L硫酸钠溶液,然后将离心管置于微沸水浴中加热10min,同时用玻璃棒不断搅拌,趁热用缓冲溶液将离心管中的溶液转移到50mL容量瓶中,冷却至室温(约20℃)后,用缓冲溶液稀释至刻度,摇匀,用滤纸过滤,弃去初滤液备用。
⑤测定
a.测定条件:波长为340nm;温度为20~25℃;比色浓度,在0.1~2.0mL试液中,含D-异柠檬酸3~100μg。
b.测定步骤:按表3-2-13中规定的程序和溶液的加入量,用微量可调移液管依次将各种溶液加入比色皿中(微量可调移液管必须用吸入方式至少冲洗一次,再正式吸取溶液),立即用玻璃棒上下搅拌,使比色皿中的溶液充分混匀,加异柠檬酸脱氢酶溶液后的最终体积为3.05mL。
表3-2-13 溶液加入量
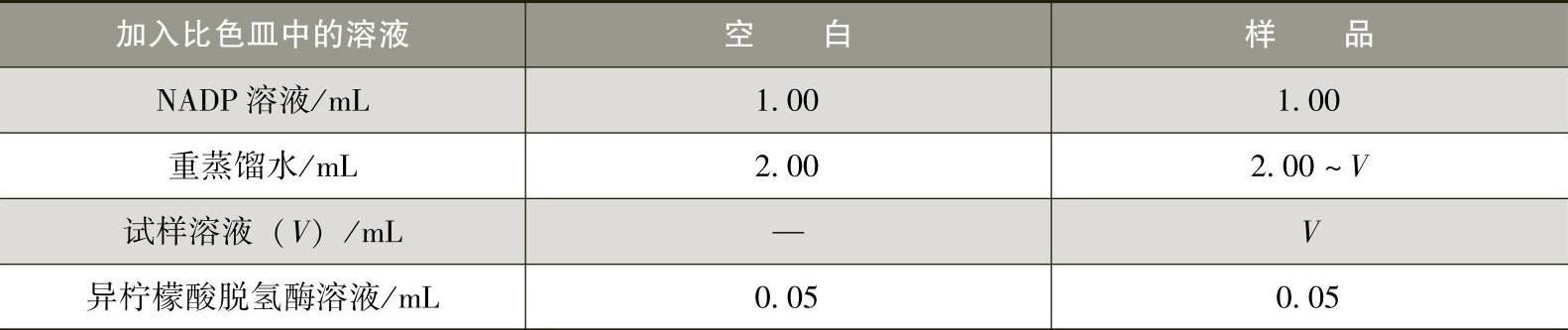
注:加入NADP溶液、重蒸馏水、试样溶液后混匀,约3min后分别测定空白吸光度(A1空白)和样品吸光度(A1样品),然后加入异柠檬酸脱氢酶溶液,混匀,约10min达到反应终点,出现恒定的吸光度,分别记录空白吸光度(A2空白)和样品吸光度(A2样品)。如果10min后未达到反应终点,则每2min测定一次吸光度,待吸光度恒定增加时,分别记录空白和样品开始恒定增加时的吸光度(A2空白和A2样品)。
上述步骤完成后计算ΔA。
ΔA=ΔA样品-ΔA空白=(A2样品-A1样品)-(A2空白-A1空白) (3-2-31)
为了得到精确的测定结果,ΔA必须大于0.100,若小于0.100,则应增加水解时的取样量或增加比色时的吸取量。
c.异柠檬酸脱氢酶活力的判定
•D-异柠檬酸标准溶液:称取0.0153/Pg含有2个结晶水的D-异柠檬酸三钠盐(C6H5Na3·2H2O)基准试剂,精确至0.0001g,置于50mL烧杯中。加水溶解,转移到100mL容量瓶中,用水定容至刻度,摇匀,储存于冰箱中。此溶液中D-异柠檬酸的含量为100mg/L。P为D-异柠檬酸基准试剂的纯度(百分含量),0.0153为系数,由式(3-2-32)计算得出。
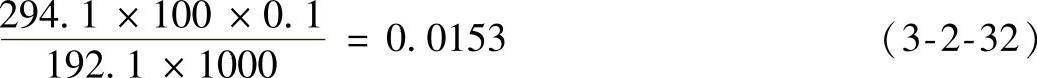
式中 294.1——C6H5O7Na3·2H2O的相对分子质量;
100——稀释体积(mL);
0.1——D-异柠檬酸的质量浓度(g/L);
192.1——D-异柠檬酸的相对分子质量。
•酶活力与标样吸潮的判定见表3-2-14。
表3-2-14 酶活力与标样吸潮的判定
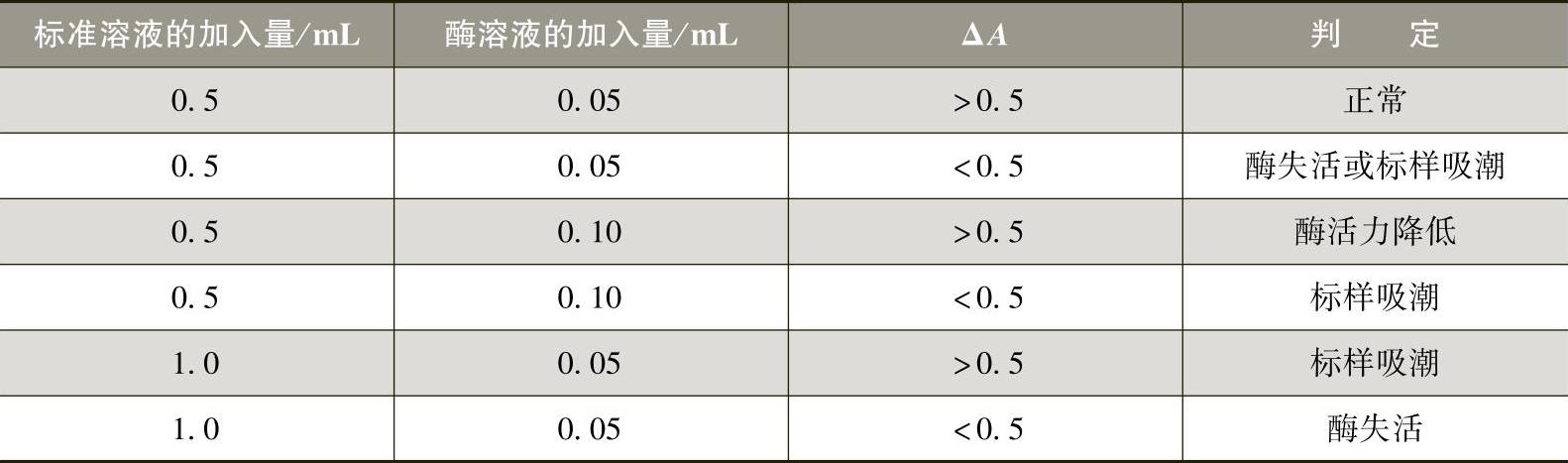
若酶活力降低,则应控制测定样品的ΔA,使之小于标样的ΔA,以保证测定样品中总D-异柠檬酸反应完全。
3)结果计算:样品总D-异柠檬酸的含量按式(3-2-33)计算。

式中 x5——样品中D-异柠檬酸的含量(mg/kg);
3.05——比色皿中溶液的最终体积(mL);
192.1——D-异柠檬酸的摩尔质量(g/mol);
V5——试液的定容体积(mL);
V′5——比色测定时吸取滤液的体积(mL);
m5——样品的质量(g);
1——比色皿光程(cm);
6.3——反应产物NADPH在340nm处的吸光系数。
计算结果精确至小数点后第一位。
允许差:同一样品的两次测定结果之差,果汁含量等于或大于10%的样品,不得超过平均值的50%;果汁含量为2.5%~100%的样品,不得超过平均值的10.0%。
(6)总黄酮的测定
1)原理:橙、柑、桔中的黄烷酮类(橙皮苷、新橙皮苷)与碱作用,开环生成2,6-二羟基-4-环氧基苯丙酮和对甲基苯甲醛,在二甘醇环境中遇碱缩合生成黄色橙皮素查耳酮,基生成量相当于橙皮苷的量。在波长420nm处比色测定吸光度,扣除本底后与标准系列溶液比较定量。
2)操作步骤
①试液的制备:称取一定量混合均匀的样品(浓缩汁质量为2.00~5.00g,果汁质量为10.0g,果汁饮料、水果饮料和果汁型碳酸饮料质量为50.0g)置于100mL烧杯中,加入10mL氢氧化钠溶液(0.1mol/L),用氢氧化钠溶液(4mol/L)调至pH=12,静置30min后,用柠檬酸溶液(200g/L)调至pH=6,转移到100mL容量瓶中,用水定容至刻度,用滤级过滤,收集澄清滤液,备用。
②工作曲线的绘制:分别吸取0.00mL、1.00mL、2.00mL、3.00mL、4.00mL、5.00mL200mg/L的橙皮苷标准使用液,分别置于6支25mL具塞试管中,分别依次加入5.00mL、4.0mL、3.0mL、2.0mL、1.0mL、0.0mL试剂空白液(量取20mL0.1mol/L氢氧化钠溶液置于50mL烧杯中,用200g/L柠檬酸调至pH=6,移到100mL容量瓶中,用水定容至刻度,摇匀),摇匀,再各加体积分数90%的二甘醇50mL、4mol/L氢氧化钠溶液0.1mL,摇匀,配制成0.0mg/L、20.0mg/L、40.0mg/L、60.0mg/L、80.0mg/L、100mg/L总黄酮标准系列溶液。将上述试管置于40℃恒温水浴中保温10min,取出,在冷水浴中冷却5min。用1cm比色皿,以试剂空白调节零点,在波长420nm处测定各溶液的吸光度。以吸光度为纵坐标,相应的黄酮含量为横坐标,绘制工作曲线或计算回归方程。
③测定:吸取1~5mL试液,置于具塞试管中,用试剂空白液补充至5mL,加5.0mL二甘醇(休积分数为90%),摇匀后加0.1mL氢氧化钠溶液(4mol/L),摇匀。同时吸取一份等量的试液,按上述步骤不加4mol/L的氢氧化钠作为空白调零,以下按工作曲线的绘制操作,测定试液吸光度,从工作曲线上查出(或用回归方程计算出)试液中总黄酮的含量。
3)结果计算:样品中总黄酮的含量按式(3-2-34)计算。
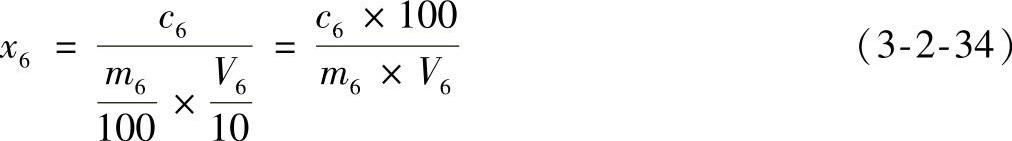
式中 x6——样品中总黄酮的含量(mg/kg);
c6——从工作曲线上查出(或用回归方程计算出)的试液中总黄酮的含量(mg/L);
m6——样品的质量(g);
V6——测定时吸取试液的体积(mL)。
同一样品的两次结果之差不得超过平均值的5.0%。
4)结果判断:饮料中果汁的含量按式(3-2-35)计算。

式中 y——果汁含量;
xi——样品中相应的钾、总磷、氨基酸态氮、L-脯氨酸、总D-异柠檬酸、总黄酮含量的实测值(mg/kg);
Xi——相应的钾、总磷、氨基酸态氮、L-脯氨酸、总D-异柠檬酸、总黄酮的标准值(mg/kg);
Ri——相应的钾、总磷、氨基酸态氮、L-脯氨酸、总D-异柠檬酸、总黄酮的权值。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




