1.检验程序
大肠菌群MPN计数法检验程序如图2-2-2所示。
2.样品的稀释
1)固体和半固体样品:称取25g样品,放入盛有225mL磷酸盐缓冲液或生理盐水的无菌均质杯内,以8000~10000r/min的转速均质1~2min;或放入盛有225mL磷酸盐缓冲液或生理盐水的无菌均质袋中,用拍击式均质器拍打1~2min,制成1∶10的样品匀液。
2)液体样品:用无菌吸管吸取25mL样品置盛有225mL磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1∶10的样品匀液。样品匀液的pH值应为6.5~7.5,必要时分别用1mol/L的NaOH溶液或1mol/L的HCl溶液调节。
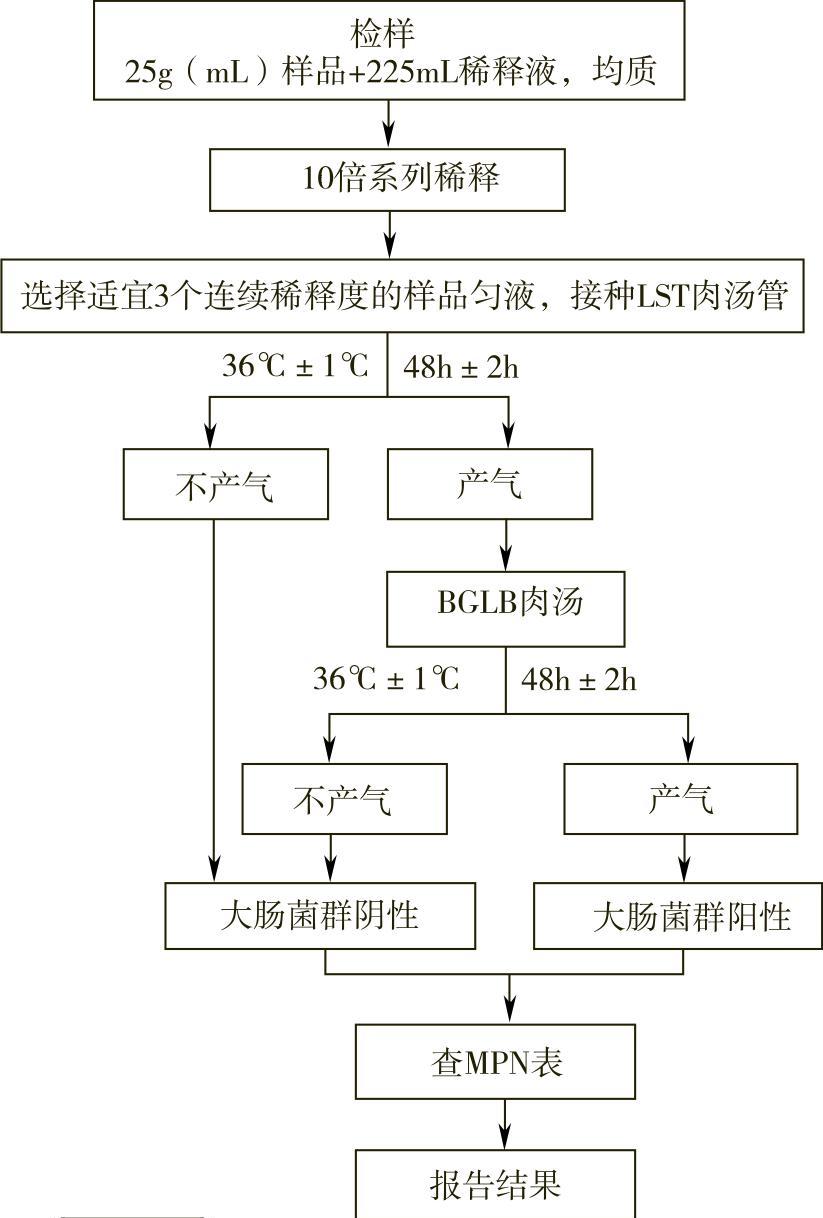
图2-2-2 大肠菌群MPN计数法检验程序
3)用1mL无菌吸管或微量移液器吸取1∶10样品匀液1mL,沿管壁缓缓注入盛有9mL磷酸盐缓冲液或生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支1mL无菌吸管反复吹打,使其混合均匀,制成1∶100的样品匀液。(https://www.xing528.com)
4)根据对样品污染状况的估计,按上述操作,依次制成10倍递增系列稀释样品匀液。每递增稀释一次,换用1支1mL无菌吸管或吸头。从制备样品匀液至样品接种完毕,全过程的时间不得超过15min。
3.初发酵试验
每个样品选择3个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管接种1mL(若接种量超过1mL,则用双料LST肉汤),于36℃±1℃培养24h±2h,观察倒管内是否有气泡产生。对24h±2h内产气者进行复发酵试验;若未产气,则继续培养至48h±2h,对于产气者进行复发酵试验,而未产气者为大肠菌群阴性。
4.复发酵试验
用接种环从产气的LST肉汤管中分别取培养物1环,移种于煌绿乳糖胆盐(BGLB)肉汤管中,于36℃±1℃培养48h±2h,观察产气情况,将产气者计为大肠菌群阳性管。
5.大肠菌群最可能数(MPN)的报告
按确证的大肠菌群LST阳性管数,检索MPN表(见附录B),报告每克(毫升)样品中大肠菌群的MPN值。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




