不同的金属材料具有不同的性能,即使同一种金属材料在不同的条件下,其性能也不尽相同。性能上的差异,是由其内部原子的排列方式不同即金属的晶体结构不同造成的。
一、晶体结构
1.晶体与非晶体
晶体与非晶体的区别不在于外表,而是在内部原子的排列上。凡是物质内部的原子按一定规律排列的称为晶体,如食盐、冰糖等都是晶体;凡是物质内部的原子没有规律、无序堆积在一起的称为非晶体,例如松香、玻璃、橡胶等。晶体的最大特点就是内部原子按一定的规律整齐地排列着。
由于晶体和非晶体中原子的排列不同,因而其性能也不同。晶体具有一定的熔点而非晶体则没有;晶体的性能在不同的方向上具有不同的数值,即各向异性,而非晶体则是各向同性。
2.晶格与晶胞
为了研究问题的方便,在研究晶体的结构时,通常把原子看成一个在其中心位置上静止不动的刚性小球,这样就得到了原子在空间排列的球体模型,如图1-21a所示,这种球体模型的优点是立体感强、很直观。
但许多球密密麻麻地堆积在一起,很难看清内部原子的排列规律和特点。如果把每一个原子想象成一个点,代表原子的振动中心,把这些点用线连接起来就得到了一个能够反映原子在晶体中排列规律的空间格架,这个空间格架被称为晶格,如图1-21b所示。由于晶格具有周期性的特点,可以从晶格中提取一个具有代表性的几何小单元来研究,这个能够完整反映晶格特征的最小几何单元称为晶胞,如图1-21c所示。可以认为整个晶格就是由晶胞在空间重复堆积而成的,晶胞中原子的排列规律能够代表整个晶格的原子排列规律。
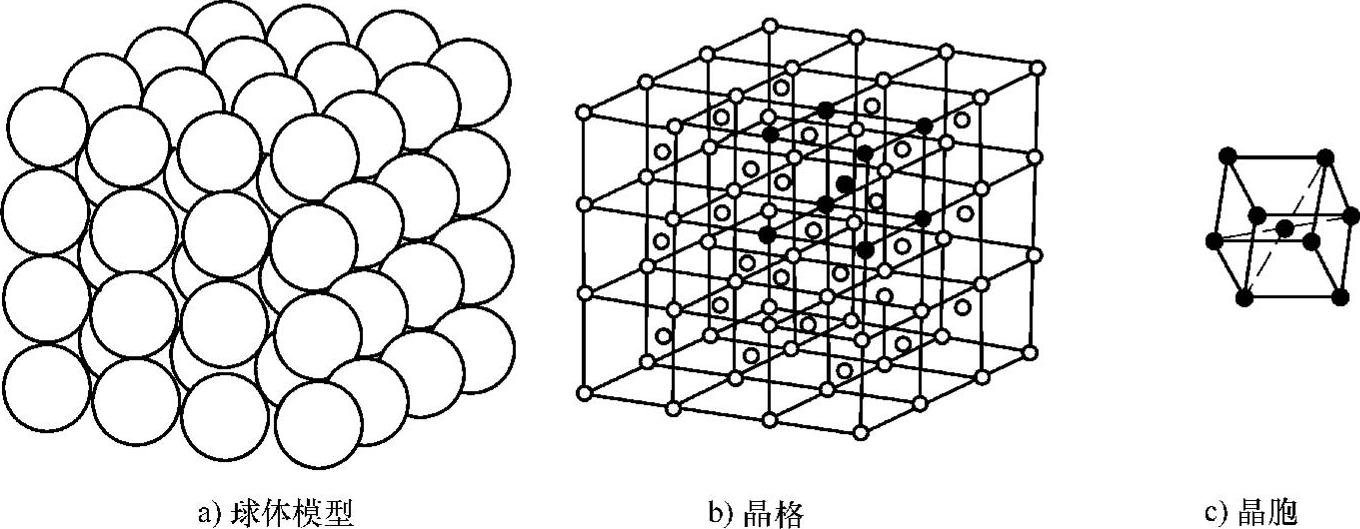
图1-21 晶体中原子排列示意图
3.常见的3种金属晶胞结构
在已知的金属材料中大多数都具有比较简单的晶胞结构,其中最典型、最常见的晶胞结构有3种,即体心立方晶胞、面心立方晶胞和密排六方晶胞。
(1)体心立方晶胞
体心立方晶胞如图1-22a所示,其晶胞是一个立方体,在立方体的8个顶点上各分布着一个原子,另外在立方体的体中心上还有一个原子,体中心上的原子与角上的原子彼此接触。
(2)面心立方晶胞(https://www.xing528.com)
面心立方晶胞如图1-22b所示,其晶胞是一个立方体,在立方体的8个顶点上各分布着一个原子,另外在立方体的6个面中心上还各有一个原子,面中心上的原子与角上的原子彼此接触。
(3)密排六方晶胞
密排六方晶胞如图1-22c所示,其晶胞是一个六方柱体,在六方柱体的12个顶点上各分布着一个原子,另外在上下底面的面中心上还各有一个原子,晶胞内部还有3个原子。真正的密排六方结构上下底面的原子与晶胞中间3个原子紧密接触。
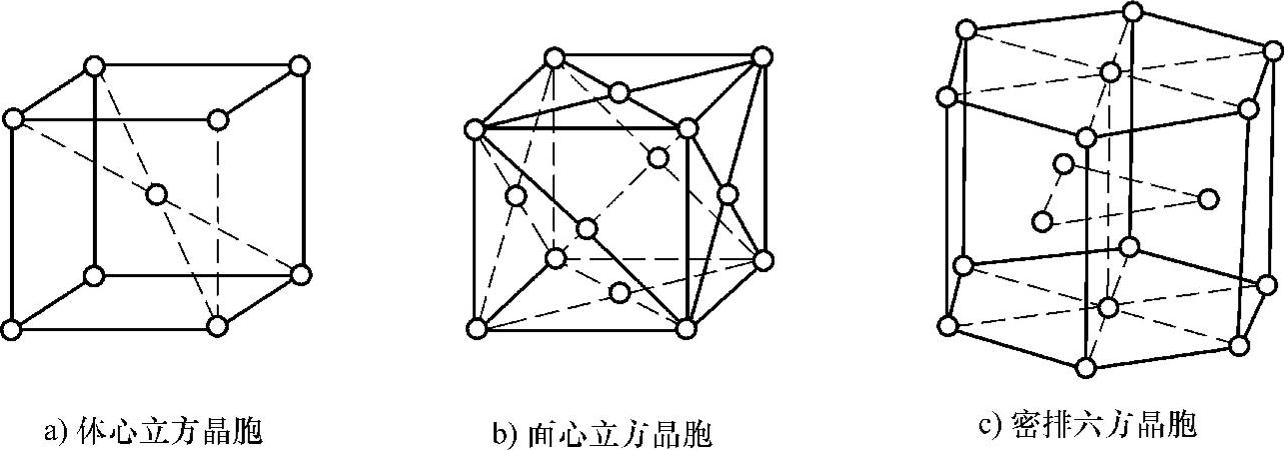
图1-22 常见的3种金属晶胞结构
二、同素异构转变
1.同素异构转变
许多金属材料在固态下只有一种晶格,如铝、铜、金、银等。而有些金属材料却不是这样,在固态下存在着两种以上的晶格类型,如铁、锰、钛、钴等,它们在固态下随温度的改变,晶格类型也会发生变化。金属材料在固态下随温度的改变由一种晶格转变为另一种晶格的现象称为金属的同素异构转变;同一种金属在不同温度下得到的不同晶格结构的晶体称为同素异晶体,按其稳定存在的温度,由低温到高温依次用希腊字母α、β、γ、δ等表示,如α-Fe、γ-Fe、δ-Fe等。
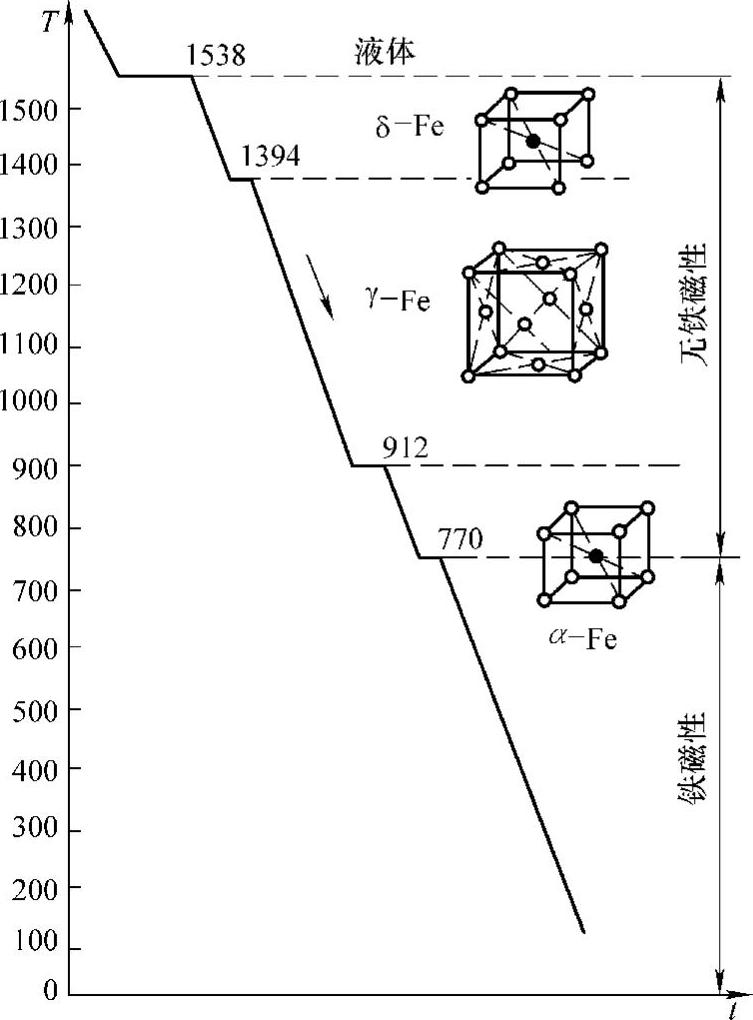
图1-23 纯铁的冷却趋势图
2.纯铁的同素异构转变
如图1-23所示为纯铁的冷却曲线。
液态纯铁在1538℃时进行结晶,得到了具有体心立方晶格的δ-Fe;温度继续降低到1394℃时,具有体心立方晶格的δ-Fe发生同素异构转变,转变为具有面心立方晶格的γ-Fe;随着温度的继续降低,降到912℃时,具有面心立方晶格的γ-Fe发生同素异构转变,转变为具有体心立方晶格的α-Fe,温度再继续降低到室温,晶格类型不再发生变化。纯铁的同素异构转变可以用下面的表达式表示出来:
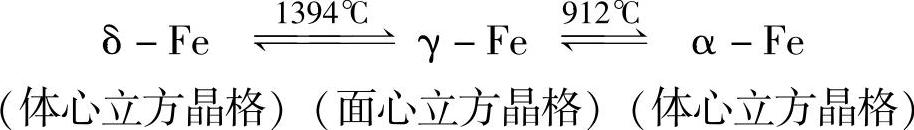
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




