由于各种原因锌涂层不可能完全纯净或绝对均匀,总含有一定量的杂质和存在电化学性质不均匀的区域,当它处于介质溶液中就构成无数微观的不能区分的阳极区和阴极区,形成局部腐蚀电池,即遭受电化学腐蚀。
在锌涂层与介质溶液形成的腐蚀电池中,其阳极过程为,锌涂层中活性高的部分遭受溶解,以离子的形式进入溶液,并把当量的电子留在锌涂层上;而阴极过程为,从阳极流过来的电子被电解质溶液中能够吸收电子的氧化性物质所接受,然后在锌涂层的非活性区域发生反应。由于阳极过程和阴极过程是互不依赖的相对独立过程,并且阳极过程在起始电极电位较低的表面区域易于进行,因此,阴极、阳极过程将主要是在局部进行。电流在阳极和阴极之间的流动是这样实现的:在锌涂层中是依靠电子从阳极流向阴极,而在溶液中是依靠离子的迁移,即阳离子从阳极区向阴极区移动,以及阴离子从阴极区向阳极区的迁移,这样就使整个电池系统中的电路构成通路。
从电化学腐蚀热力学观点来判断电化学腐蚀能否自发进行的一个最常用的方法,是用金属在该金属的盐溶液中的平衡电位(标准电极电位)高低作为判据。但由于锌涂层的电化学腐蚀大都是在非平衡状态和非平衡条件下发生的,因而实际测量得到的电极在具体使用的电解质溶液中的稳定电位高低,作为判据更能反映实际情况。在3%(质量分数)NaCl溶液中,Zn/Zn2+和Fe/Fe+的标准电极电位分别是-0.763mV和-0.440mV。因此,即使锌涂层由于各种原因使铁基体暴露在外,当锌涂层发生电化学腐蚀时,锌首先作为阳极被溶解,而铁基体作为阴极受到保护。
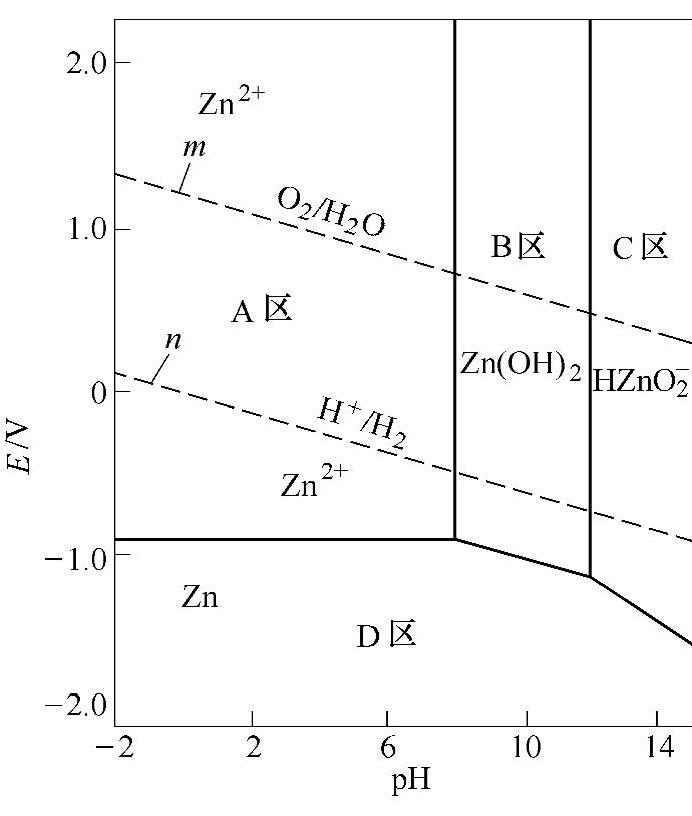
图1-3 锌在水溶液体系中的E-pH图(https://www.xing528.com)
注:E为相对于标准氢电极的电极电位。
图1-3所示为锌在水溶液体系中的E-pH图图中,m线表示在25℃和p(H2)=0.1MPa时氧电极反应的E-pH关系,n线表示在25℃和p(H2)=0.1MPa时氢电极反应的E-pH关系。在常温下,水的电位在m线和n线之间是热力学稳定区,水可分解成分压小于1的氢和氧。当电位高于m线时即析出氧,低于n线时则析出氢。因此,锌在水溶液中的电化学腐蚀过程,除了锌的离子化反应外,还将同时产生氢的析出或氧的还原反应。
在图1-3中,锌的E-pH图可分为四个区域:腐蚀区(A区)、钝化区(B区)、腐蚀区(C区)、稳定区(D区)。从图中可以看出,当锌处于腐蚀状态下,降低电位可使腐蚀向稳定区转变;保持pH值在8~12,进入钝化区,有利于形成钝化膜实现钝化保护。
锌的E-pH图是研究锌在水溶液介质中腐蚀行为的重要工具,可以预测腐蚀反应的倾向,估计腐蚀产物的组成,预测可防止或减轻腐蚀的环境变化范围,为防腐蚀提供可能的途径。但锌的E-pH图的应用存在一些局限性:只应用于平衡态;一般适用于常温25℃,温度的变化可改变其区域的相对位置和区域范围大小;不能用于预测腐蚀速度;合金元素会影响E-pH图中区域大小等。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




