(1)方法提要 试样经酸溶解,在硫酸-磷酸介质中,以硝酸银为催化剂,用过硫酸铵将铬氧化成六价。以N-苯代邻氨基苯甲酸溶液为指示剂,用硫酸亚铁铵标准溶液滴定铬。
锰的干扰可用氯化钠还原而消除。含钒的试样,应以亚铁-邻菲罗啉溶液为指示剂,加过量的硫酸亚铁铵标准溶液,用高锰酸钾标准溶液回滴。
本方法适用于高温合金中铬含量的测定,也适用于钢铁中铬含量的测定,测定范围为0.10%~50.00%(质量分数)。
(2)主要试剂
1)盐酸(1.19g/mL)、硝酸(1.42g/mL)、磷酸(1.69g/mL)、氢氟酸(1.15g/mL)、盐酸(1+3)、硫酸(1+1)、硫酸(5+95)。
2)无水乙酸钠:固体。
3)硫酸-磷酸混合酸:于600mL水中加入320mL硫酸溶液(1+1)及80mL磷酸(1.69g/mL),摇匀。
4)硝酸银溶液(10g/L):储于棕色瓶中。
5)过硫酸铵溶液(300g/L):现用现配。
6)氯化钠溶液(50g/L)。
7)硫酸锰溶液(40g/L)。
8)亚铁-邻菲罗啉溶液:称取1.49g邻菲罗啉、0.98g硫酸亚铁铵置于300mL烧杯中,加入50mL水,加热溶解,冷却,用水稀释至100mL,摇匀。
9)铬标准溶液A(2.00mg/mL):称取5.6578g基准重铬酸钾(预先经150℃烘1h,并于干燥器中冷却至室温)置于300mL烧杯中,用过量水溶解,移入1000mL容量瓶中,用水稀释至刻度,摇匀。
10)铬标准溶液B(1.00mg/mL):用标准溶液A配制。
11)铬标准溶液C(0.50mg/mL):用标准溶液A配制。
12)硫酸亚铁铵标准溶液:(NH4)2Fe(SO4)2的浓度约为0.015mol/L、0.03mol/L、0.06mol/L或0.12mol/L。称取6g、12g、24g、48g硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O],分别溶解于硫酸溶液(5+95)中,并用硫酸溶液(5+95)稀释至1000mL,摇匀。
硫酸亚铁铵标准滴定溶液浓度的标定及指示剂的校正方法为:于三个500mL锥形瓶中,各加入50mL硫酸-磷酸混合酸,加热蒸发至冒硫酸烟,稍冷,加入50mL水,冷却至室温,分别加入铬标准溶液(其量应与待测试样中的铬含量相近),用水稀释至200mL,选用适宜的硫酸亚铁铵标准溶液滴定至溶液呈淡黄色,加入3滴N-苯代邻氨基苯甲酸溶液,继续滴定至由玫瑰红色变亮绿色为滴定终点,读取所消耗的硫酸亚铁铵标准溶液的毫升数,加入相同量的铬标准溶液,再用同一硫酸亚铁铵标准溶液滴定至由玫瑰红色变亮绿色为滴定终点。两者消耗硫酸亚铁铵标准溶液体积的差值,即为3滴N-苯代邻氨基苯甲酸溶液的校正值。将此值加入硫酸亚铁铵标准溶液消耗的体积中,再行计算。三份铬标准溶液所消耗硫酸亚铁铵标准溶液毫升数的极差值应不超过0.05mL,取其平均值。计算硫酸亚铁铵标准溶液对铬的滴定度T(g/mL)。
13)高锰酸钾标准滴定溶液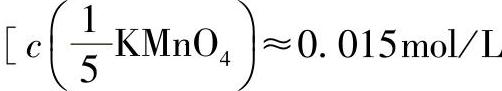 、0.03mol/L、0.06mol/L或0.12mol/L]:称取0.48g、0.95g、1.9g、3.8g高锰酸钾,分别置于1000mL烧杯中,用水溶解后加入5~10mL磷酸(1.69g/mL),用水稀释至1000mL,储存于棕色瓶中,在阴凉处放置6~10天,使用前用坩埚式过滤器过滤后使用。
、0.03mol/L、0.06mol/L或0.12mol/L]:称取0.48g、0.95g、1.9g、3.8g高锰酸钾,分别置于1000mL烧杯中,用水溶解后加入5~10mL磷酸(1.69g/mL),用水稀释至1000mL,储存于棕色瓶中,在阴凉处放置6~10天,使用前用坩埚式过滤器过滤后使用。
高锰酸钾标准溶液浓度的标定方法为:移取25.00mL硫酸亚铁铵标准溶液三份,分别置于250mL锥形瓶中,以相应浓度的高锰酸钾标准溶液滴定至溶液呈粉红色,在1~2min内不消失为终点,三份硫酸亚铁铵标准溶液所消耗高锰酸钾标准溶液毫升数的极差值应不超过0.05mL,取其平均值。计算出高锰酸钾标准溶液相当于硫酸亚铁铵标准溶液的体积比,计算公式为
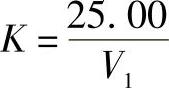
式中 K——高锰酸钾标准溶液相当于硫酸亚铁铵标准溶液的体积比;
V1——滴定时所消耗高锰酸钾标准溶液的体积(mL);
25.00——移取硫酸亚铁铵标准溶液的体积(mL)。
14)N-苯代邻氨基苯甲酸(2.0g/L):称取0.2g试剂置于300mL烧杯中,加入0.2g无水碳酸钠,加入20mL水,冷却后用水稀释至100mL,摇匀。
(3)分析步骤
1)试样:按表4-2称取试样,精确至0.0001g。
2)空白试验:随同试样做空白试验,每次测定均应带试剂空白。
3)测定
①试液的制备
表4-2 试样量
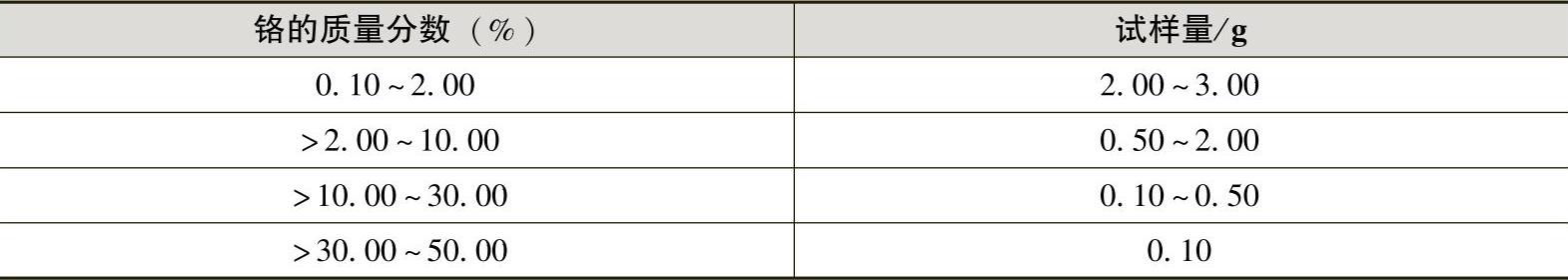
注:在称取的试样中,钨、锰量应在100mg以下,否则滴定终点不易辨认。(https://www.xing528.com)
a.试样的溶解
• 高温合金:将试样置于500mL锥形瓶中,加入20~40mL盐酸(1.19g/mL)、3~5mL硝酸(1.42g/mL),加热至试样溶解完全,再加入50mL硫酸-磷酸混合酸。
• 钢铁试样:将试样置于500mL锥形瓶中,加入50mL硫酸-磷酸混合酸,加热至试样全部溶解。
• 含高硅的试样:将试样置于500mL锥形瓶中,加入50mL硫酸-磷酸混合酸,滴加数滴氢氟酸(1.15g/mL),加热至试样全部溶解。
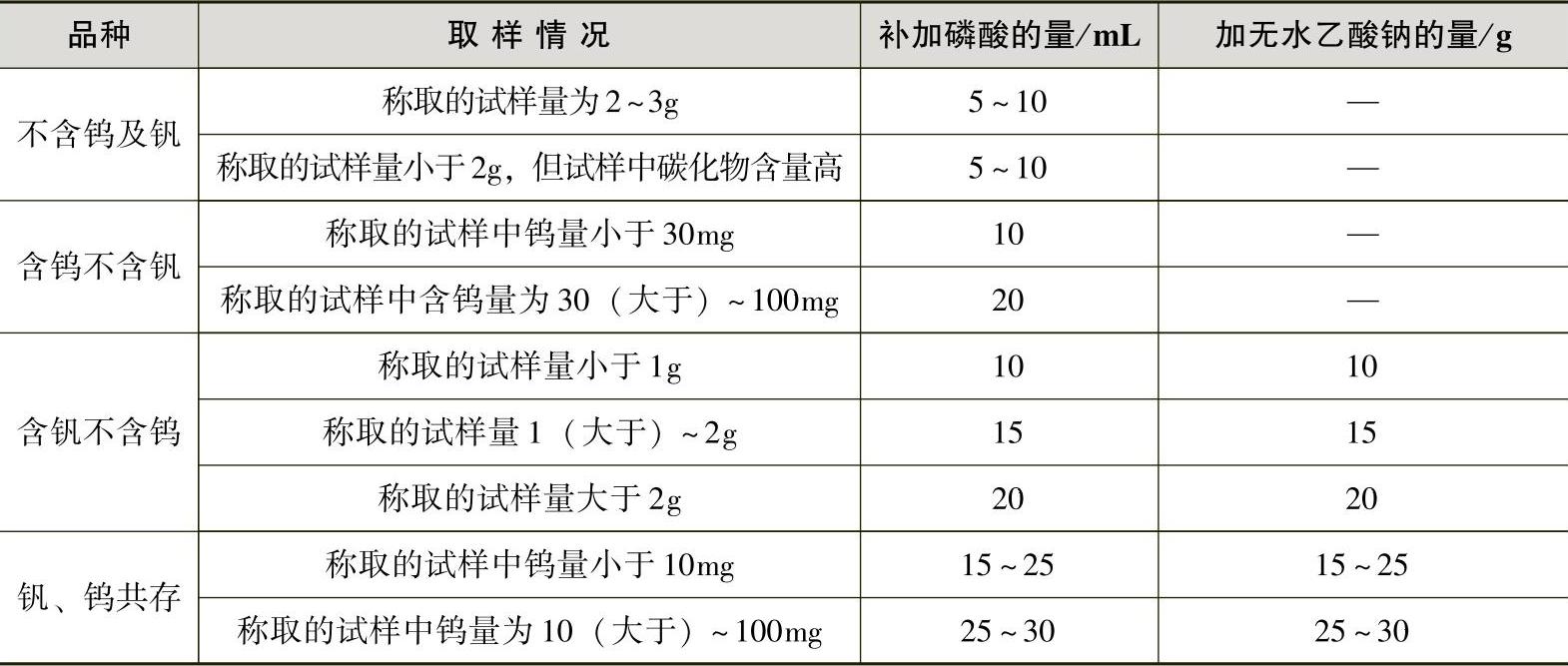
b.试液的处理:向上述试液中滴加硝酸(1.42g/mL)氧化,直到激烈作用停止后,按表4-3补加磷酸,继续加热蒸发至冒硫酸烟。高碳、高铬、高钼试样在冒硫酸烟时应滴加硝酸(1.42g/mL)氧化,直到溶液清晰、碳化物全部破坏为止。
②铬的氧化:将上述试液稍冷,用水稀释至200mL(生铁试样若有沉淀,则用水稀释至100mL,以中等密度滤纸过滤,用水洗涤5次或6次,并稀释至200mL),加入5mL硝酸银溶液(试液中含铬量大于50mg时,加入10mL硝酸银溶液)、20mL过硫酸铵溶液(若试液中含50mg铬、40mg锰,则加入30mL),摇匀,加热煮沸至溶液呈现稳定的紫红色(若试液中锰含量低,则可滴加2~4滴硫酸锰溶液),继续煮沸5min,使过量的过硫酸铵分解,稍冷,加入5mL氯化钠溶液,煮沸至溶液的紫红色消失,再持续5min。当试液中锰含量高,溶液因高锰酸未完全分解而仍呈红色时,应再加入2~3mL盐酸溶液(1+3),煮沸2~3min至溶液的紫红色消失。
表4-3 补加磷酸量
③滴定
a.不含钒的试样:先用适宜浓度的硫酸亚铁铵标准溶液滴定至溶液呈淡黄色,加入3滴N-苯代邻氨基苯甲酸溶液,继续滴定至由玫瑰红色转变为亮绿色为滴定终点。
b.含钒试样:在用适宜浓度的硫酸亚铁铵标准溶液滴定至六价铬的黄色转变为亮绿色之前,加入5滴亚铁-邻菲罗啉溶液,继续滴定至溶液呈现稳定的红色,并过量5mL,再加入5滴亚铁-邻菲罗啉溶液,以浓度相近的高锰酸钾标准溶液回滴至红色初步消失,按表4-3加入无水乙酸钠,待乙酸钠溶解后,继续用高锰酸钾标准溶液缓慢滴定至淡蓝色(铬含量高时为蓝绿色)为滴定终点。
亚铁-邻菲罗啉溶液消耗的高锰酸钾标准溶液的校正方法为:向做完高锰酸钾标准溶液相当于硫酸亚铁铵标准溶液体积比的标定后的两份溶液中,一份加入10滴亚铁-邻菲罗啉溶液,另一份加入20滴,各用与滴定试液相同浓度的高锰酸钾标准溶液滴定,两者消耗高锰酸钾标准溶液体积的差数,即为10滴亚铁-邻菲罗啉溶液的校正值。此值应从过量的硫酸亚铁铵标准溶液所消耗高锰酸钾标准溶液的体积中减去。
(4)结果计算
1)不含钒试样中铬的质量分数的计算公式为
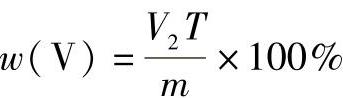
式中 V2——滴定时所消耗硫酸亚铁铵标准溶液的体积(mL);
T——硫酸亚铁铵标准溶液对铬的滴定度(g/mL);
m——称样量(g)。
2)含钒试样中铬的质量分数的计算公式为
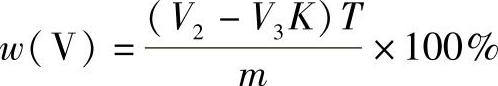
式中 V2——滴定时消耗硫酸亚铁铵标准溶液的体积(mL);
V3——过量硫酸亚铁铵标准溶液所消耗高锰酸钾标准溶液的体积减去亚铁-邻菲罗啉溶液的校正值后的体积(mL);
K——高锰酸钾标准溶液相当于硫酸亚铁铵标准溶液的体积比;
T——硫酸亚铁铵标准溶液对铬的滴定度(g/mL);
m——称样量(g)。
3)非仲裁分析时含钒或铈试样中铬的质量分数的计算公式为
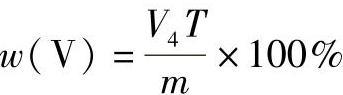
式中 V4——滴定时所消耗硫酸亚铁铵标准溶液的体积(mL);
T——硫酸亚铁铵标准溶液对铬的滴定度(g/mL);
m——称样量(g)。
所得计算结果再经校正系数[每1%(质量分数)的钒相当于0.34%(质量分数)的铬;每1%(质量分数)的铈相当于0.124%(质量分数)的铬]处理后,即得到该试样中铬的质量分数。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




