钒是钢铁中常见的合金元素之一。钒能使钢具有一些特殊的力学性能,能提高钢的抗拉强度和屈服强度,尤其是能提高钢的高温强度,提高工具钢刀具的使用寿命。钒和硫、氮、氧都有强亲和力,在炼钢时,可作细化晶粒的脱氧剂。
钒在钢中主要形成稳定的碳化物,如V4C3、V2C等或更复杂的碳化物。钒也可与硫、氧、氮形成极稳定的化合物,在铁中形成固溶体。钒的碳化物坚硬而稳定,用硫酸或盐酸处理试样几乎不被分解,只有一些强氧化剂(如硝酸、过硫酸铵、高氯酸冒烟等)才能将其破坏,也可用硫磷酸冒烟。单质钒可溶解于稀的硝酸盐酸混合酸中,溶解后呈钒(Ⅳ)状态(呈蓝色),被强氧化剂氧化后呈钒(Ⅴ)状态(呈黄色)。
钒对化学分析的影响主要表现为:一是钒在溶液中有颜色,用光度法测定时需要考虑色泽空白;二是五价钒化合物是氧化剂,不稳定,易被还原,对某些有机显色剂有氧化作用。此外,五价钒能与磷、钼一起生成络合物,使磷的测定结果偏低,通常用亚铁将其还原成低价以消除其干扰。
测定钢铁中钒的方法很多,氧化还原滴定法是最常用的简便、准确的方法。根据氧化剂的不同,可分为高锰酸钾氧化法、硝酸(或硝酸铵)氧化法、过硫酸铵氧化法及过氧化氢氧化法。利用钒(Ⅴ)氧化二苯胺磺酸钠而使其呈紫色仍是目前微量钒测定中最简单、快速的直接光度法。基于钒(Ⅴ)与N-苯甲酰苯胲(钽试剂)在强酸性溶液中形成水不溶性络合物,用氯仿或苯萃取的萃取光度法也是测定钢铁中微量钒的常用方法之一。近年来,三(多)元络合物显色体系测定钒的方法很多,应用于钢铁分析中的有钒(Ⅴ)-PAR-H2O2、钒(Ⅴ)-PADAP-H2O2及钒(Ⅴ)-三溴连苯三酚-二苯胍体系等。
1.高锰酸钾氧化-亚铁滴定法
(1)方法提要 试样经酸分解后,加硝酸氧化,加硫磷混合酸冒烟破坏碳化物。在室温下,用高锰酸钾将钒氧化为钒(Ⅴ),过量的高锰酸钾在尿素存在的情况下用亚硝酸钠还原,并加亚砷酸钠选择性地还原可能生成的高价铬(Ⅵ),最后用亚铁标准溶液滴定钒(Ⅴ)。
本方法适用于生铁、碳素钢、合金钢、精密合金、高温合金中钒的测定,测定范围大于0.1%(质量分数)。
(2)主要试剂
1)硫磷混合酸:将150mL硫酸溶于700mL水中,冷却后,加150mL磷酸,用水稀释至1000mL。
2)亚砷酸钠溶液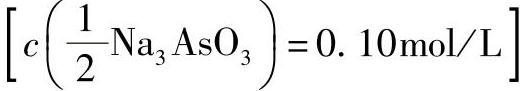 :向100mL水中加入0.49gAs2O3、1.0g无水碳酸钠,加热溶解。
:向100mL水中加入0.49gAs2O3、1.0g无水碳酸钠,加热溶解。
3)重铬酸钾标准溶液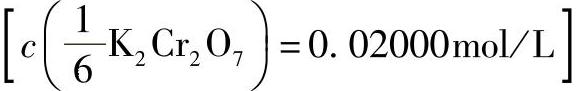 :称取0.9806g基准重铬酸钾,溶于水中,于容量瓶中稀释至1000mL。
:称取0.9806g基准重铬酸钾,溶于水中,于容量瓶中稀释至1000mL。
4)硫酸亚铁铵溶液(4%):采用硫酸溶液(5+95)配制。
5)硫酸亚铁铵标准溶液[c(Fe2+)=0.020mol/L]:将8.0g硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]溶解于300mL水中,加入50mL硫酸,冷却后用水稀释至1000mL。在溶液中放入纯铝片或纯铝线(可将电缆铝线绕成弹簧状放入,纯铝中应基本不含铁、锰),放置数天,使溶液中存在的少量Fe3+还原,然后用0.02000mol/L重铬酸钾标准溶液标定,溶液浓度基本可以保持一个月以上。标定方法参见本节中“锰的测定”。
6)N-苯代邻氨基苯甲酸指示剂溶液(0.2%):在100mL水中加入0.2gN-苯代邻氨基苯甲酸、0.2g无水碳酸钠,加热溶解。
指示剂本身具有还原性,校正值按下述方法测定:在150mL锥形瓶中,用滴定管或移液管移取5mL偏钒酸铵溶液(0.020mol/L,配制方法为:将2.340g NH4VO3溶解于热水中,冷却后于容量瓶中稀释至1000mL),加30mL硫磷混合酸和3滴指示剂溶液,然后用0.020mol/L硫酸亚铁铵标准溶液滴定至绿色为终点。在接近终点时,滴定速度要慢,另取一份偏钒酸铵溶液,加1滴指示剂溶液,同样滴定,两者所用硫酸亚铁铵标准溶液体积(mL)之差,即相当于2滴指示剂的校正值。指示剂的校正值随溶液中钒含量的增加而增加,通常取每滴指示剂的校正值相当于0.020mol/L硫酸亚铁铵标准溶液0.03mL。
7)硫酸镍溶液(20%):采用硫酸溶液(1+24)配制。
(3)分析步骤称取0.5~1.0g试样,置于200mL锥形瓶中,加35mL硫磷混合酸(钨含量高的钢应多加5mL磷酸),加热溶解,滴加2mL硝酸氧化(如果试样不易溶解,可先用王水或盐酸-过氧化氢溶解后加硫磷混合酸),蒸发至冒硫酸白烟,如果有黑色碳化物不溶,可稍冷,补加1~2mL硝酸,重复蒸发冒烟。稍冷,加约40mL(高钨钢约30mL)水,加热溶解盐类[如果有石墨炭,则应当过滤,并用硫酸溶液(5+95)洗涤并浓缩至30~40mL],冷却,加2mL硫酸亚铁铵溶液(4%),摇匀,滴加高锰酸钾溶液(1%)至呈稳定的微红色,加1g尿素,放置1~2min后,滴加亚硝酸钠溶液(1%)至红色褪去,加3~5mL亚砷酸钠溶液(0.1mol/L),再滴加2~4滴亚硝酸钠溶液(1%),放置1~2min后,加入2滴指示剂,用硫酸亚铁铵标准溶液(0.020mol/L)滴定至亮绿色为终点。
(4)结果计算 钒的质量分数的计算公式为
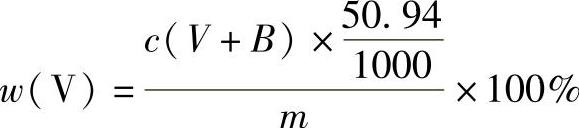
式中 c——硫酸亚铁铵标准溶液的浓度(mol/L);
V——滴定时所消耗硫酸亚铁铵标准溶液的体积(mL);
B——指示剂的校正值,每滴指示剂约相当于0.020mol/L硫酸亚铁铵标准溶液0.03mL(mL);
50.94——钒的摩尔质量(g/mol);
m——称样量(g)。
(5)附注
1)通常钒的质量分数为0.1%~0.3%时,称取1.0000g试样;钒的质量分数大于0.3%时,称取0.5000g试样。钴含量较高的试样,如铁钴钒、钴铬钼钒磁钢等,称取0.10000g试样。按上述步骤操作至高锰酸钾氧化前,先加硫酸镍溶液(20%)至钴的粉红色被掩蔽后,再用高锰酸钾氧化,以下操作同分析步骤。
2)用高锰酸钾氧化钒时,要尽可能控制铬等不被氧化或即使铬被氧化了也不被硫酸亚铁标准溶液滴定。尤其是在分析高铬试样时要注意这一点。铬的氧化与铬含量、温度、高锰酸钾用量、酸度及氧化时间等因素有关。因此,在操作中通常采用以下一些必要的措施:
①采用硫磷酸冒烟,可起到还原溶解试样中产生的铬(Ⅵ)的作用,尤其当测定高钨钢中的钒时效果更明显。
②采用高锰酸钾氧化前,加少量硫酸亚铁铵溶液还原可能存在的锰(Ⅲ)、铬(Ⅵ),尤其是高铬、高锰试样必须这样做。
③氧化钒时,高锰酸钾溶液不能过量太多,微红色已经足够(高铬试样呈暗绿色),否则,铬有被氧化的倾向,尤其是高铬试样,不可避免铬被氧化,但应尽可能不使被氧化的铬量太多。
④滴定前,加亚砷酸钠选择性地还原铬(Ⅵ),再加亚硝酸钠还原由于铬的诱导反应而氧化的锰(Ⅲ),这对高铬低钒试样、高铬高钴试样(钴的催化作用使铬易被氧化)尤为重要。
⑤在低温时(低于15℃)应加高锰酸钾氧化。
⑥高铬试样也可借高氯酸氧化,滴加盐酸或氯化钠溶液挥发铬,但只适用于钒的质量分数小于0.5%的试样。钒的质量分数为1%时,在以氯化铬酰方式驱铬时,少量钒(0.01%~0.02%)形成氯化钒酰(VOCl3)而挥发损失,因此一般不采用该方法。
3)分析含钨钢时,需按规定稀释溶液(加30mL水)。过度地稀释将导致钨干扰滴定终点,因为接近终点时呈蓝灰色,使终点不明显。磷酸用量不足或冒硫酸烟时间太短,也会出现这种现象。
4)试样中含铈时对测定有干扰,可用系数法扣除,即0.1%铈相当于0.036%的钒。
2.硝酸氧化-亚铁滴定法
(1)方法提要 试样用酸溶解,在热的硫磷酸溶液中,用硝酸将钒氧化为钒(Ⅴ),部分锰也被氧化为锰(Ⅲ),在尿素存在的情况下,用亚硝酸钠还原以消除其干扰,然后用硫酸亚铁铵标准溶液滴定。
(2)主要试剂
1)硫磷混合酸:在700mL水中加150mL硫酸,冷却后加150mL磷酸,用水稀释至1000mL。
2)亚砷酸钠溶液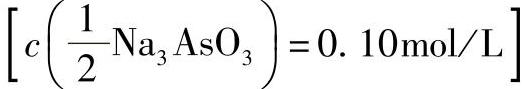 :在100mL水中,加入0.49gAs2O3、1.0g无水碳酸钠,加热溶解。
:在100mL水中,加入0.49gAs2O3、1.0g无水碳酸钠,加热溶解。
3)重铬酸钾标准溶液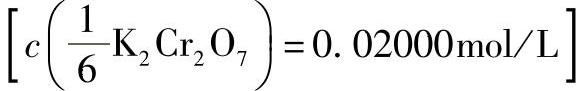 :称取0.9806g基准重铬酸钾溶于水,于容量瓶中稀释至1000mL。
:称取0.9806g基准重铬酸钾溶于水,于容量瓶中稀释至1000mL。
4)硫酸亚铁铵标准溶液[c(Fe2+)=0.020mol/L]:将8.0g硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]溶于300mL水中,加入50mL硫酸,冷却后用水稀释至1000mL。在溶液中放入纯铝片或纯铝线(可将电缆铝线绕成弹簧状放入,纯铝中应基本不含铁、锰),放置数天,使溶液中存在的少量Fe3+被还原,然后用0.02000mol/L重铬酸钾标准溶液标定,溶液浓度基本可以保持一个月以上。标定方法参见本书中“锰的测定”。
5)N-苯代邻氨基苯甲酸指示剂溶液(0.2%):在100mL水中加入0.2gN-苯代邻氨基苯甲酸、0.2g无水碳酸钠,加热溶解。
(3)分析步骤 称取1.0000g(含钨钢称取0.5000g)试样,置于200mL锥形瓶中,加15mL硫磷混合酸(高铬钢先加10mL王水溶解试样,再加15mL硫磷混合酸)、7~8mL磷酸,温热溶解,滴加2~3mL硝酸氧化,蒸发至冒白烟(若碳化物不溶,则稍冷,补加2~3mL稍酸,重复蒸发冒烟),冷却1~2min,再小心加4~5mL硝酸溶液(1+1)进行氧化,煮沸驱除氮氧化物,冷却至微热,加50mL水、10mL硫酸溶液(1+1)[高铬钢试样加100mL水、20mL硫酸溶液(1+1)],冷却,加2~3mL亚砷酸钠溶液(0.10mol/L)、3g尿素、3~5滴指示剂,使指示剂被锰(Ⅲ)氧化而显红色,然后滴加5~7滴亚硝酸钠溶液(1%)还原锰(Ⅲ),此时指示剂的红色仍保留,放置1~2min后,用硫酸亚铁铵标准溶液滴定,以溶液由樱桃红色转变为亮绿色为终点。
(4)结果计算 钒的质量分数的计算公式为
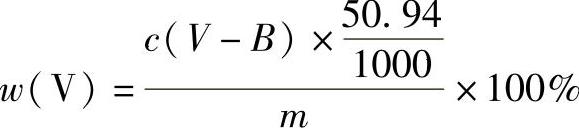
式中 c——硫酸亚铁铵标准溶液的浓度(mol/L);
V——滴定时所消耗硫酸亚铁铵标准溶液的体积(mL);
B——指示剂的校正值,约相当于0.020mol/L亚铁溶液0.03mL(mL);(https://www.xing528.com)
50.94——钒的摩尔质量(g/mol);
m——称样量(g)。
(5)附注
1)磷酸的存在有利于钒的氧化。硝酸溶液(1+1)用量为3~10mL,测定结果一致。但值得注意的是,不能用浓硝酸氧化。因为生成的氮氧化物不易驱除,常使测定结果偏低。
2)在大量磷酸存在的情况下,钒的氧化还原电位增大,较易受到亚硝酸钠溶液的影响,因此需加入大量的尿素。
3)在锰(Ⅲ)被亚硝酸钠溶液还原之前加入指示剂,使指示剂被锰(Ⅲ)氧化显色,可以降低指示剂的校正值。对于高铬试样多加指示剂的情况,与指示剂被钒(Ⅴ)氧化显色时相反,校正值应从滴定所消耗的亚铁标准溶液体积中减去。因为滴定被锰(Ⅲ)氧化的指示剂至无色时,将消耗亚铁标准溶液,不论加入指示剂多少滴,校正值都是一样的,约相当于0.020mol/L亚铁标准溶液0.03mL。校正值的测定,可以用钒的质量分数小于0.001%的钢样按上述方法操作求得。
4)通常锰的质量分数在1%以下的试样,加5~7滴亚硝酸钠溶液就可以还原全部的锰(Ⅲ),略多加无碍。高锰试样应先将锰(Ⅲ)还原,即加3g尿素,滴加亚硝酸钠溶液至锰(Ⅲ)的红色褪去,再多加2滴或3滴,放置1~2min后,加1滴或2滴指示剂,用硫酸亚铁铵标准溶液滴定至终点。这样可避免因锰未还原完全而引起误差。但钒的质量分数应按下式计算:
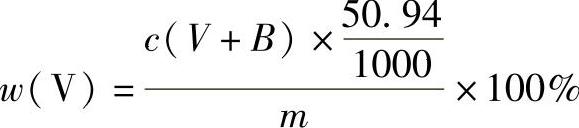
式中 c——硫酸亚铁铵标准溶液的浓度(mol/L);
V——滴定时所消耗硫酸亚铁铵标准溶液的体积(mL);
B——指示剂的校正值,每滴指示剂约相当于0.020mol/L亚铁标准溶液0.03mL(mL);
50.94——钒的摩尔质量(g/mol);
m——称样量(g)。
5)由于铬不被氧化或被氧化量极少,因此本方法对高铬试样的测定更为适合。同时,本方法还克服了高铬、高镍等试样在高锰酸钾氧化法中还原高锰酸钾时颜色不易辨认的缺点。
6)本方法中铈也被氧化,会干扰测定。
3.钽试剂-氯仿萃取光度法
(1)方法提要 用酸溶解试样,以磷酸掩蔽铁的干扰,用高锰酸钾将钒氧化为五价状态,在尿素存在的情况下,以亚硝酸钠还原过剩的高锰酸钾。在c(HCl)=4~6mol/L的盐酸介质中,加入钽试剂(N-苯甲酰苯胲,即NBPHA),使钒(Ⅴ)生成络合物,萃取到三氯甲烷中,在波长535nm处测量吸光度,从而测得钒量。
本方法适用于钢铁中钒含量的测定,测定范围为0.005%~0.5%(质量分数)。
(2)主要试剂
1)亚砷酸钠溶液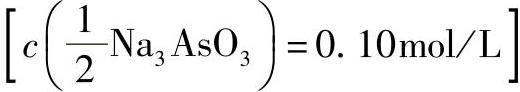 :在100mL水中,加入0.49gAs2O3、1.0g无水碳酸钠,加热溶解。
:在100mL水中,加入0.49gAs2O3、1.0g无水碳酸钠,加热溶解。
2)钽试剂三氯甲烷溶液(0.25%):储于棕色瓶中可稳定数月。
(3)分析步骤 按下列钒含量称取试样:钒的质量分数为0.005%~0.10%时,称取1.0000g试样;钒的质量分数为0.10%~0.20%时,称取0.5000g试样;钒的质量分数为0.20%~0.50%时,称取0.2000g试样。将试样置于125mL锥形瓶中,加20~30mL王水,加热溶解,加15~20mL高氯酸(当试样含钨时,加15~20mL高氯酸、5mL磷酸和5mL硝酸溶解试样),加热至冒白烟,冷却,加约30mL水溶解盐类,加几滴过氧化氢还原铬,加热至沸腾并保持1~2min,以分解过量的过氧化氢,冷却,于容量瓶中稀释至100mL(必要时可干滤)。
移取10~25mL试液,置于125mL分液漏斗中,加2mL磷酸(1+1)[如果试样中含钨,则不加磷酸;如果钛量大于1mg,加3mL三聚磷酸钠溶液(10%),以消除钛的干扰],摇匀,加0.5g尿素,滴加高锰酸钾溶液(0.3%)至溶液呈微红色,放置1min。小心滴加亚硝酸钠溶液(0.3%)至红色消退,加2~5滴(根据含铬量)亚砷酸钠溶液(0.10mol/L)以还原可能被氧化的铬,再滴1~3滴亚硝酸钠溶液(0.3%),摇匀,放置1min。用移液管加10mL钽试剂三氯甲烷溶液(0.25%)及20mL盐酸,立即振荡萃取1min,静置分层后,将有机相用干滤纸过滤于1cm或2cm比色皿中,在波长535nm处,以三氯甲烷或水作参比,测量吸光度。称取纯铁,随同试样做试剂空白一份。
(4)校准曲线的绘制 称取纯铁(不含钒或含尽可能低的已知量的钒),按试样处理,稀释至100mL。从中分取10~25mL溶液数份,分别加入不同量的钒标准溶液(10μg/mL),按分析步骤氧化、萃取与测定,绘制校准曲线。
(5)附注
1)在较浓的盐酸溶液中,钒(Ⅴ)有还原的倾向,化学反应式为
2VO3-+6Cl-+8H+=(VO)2Cl4+Cl2↑+4H2O
因此,加入盐酸后,应立即进行萃取,否则测定结果偏低。
2)萃取的有机相常因含有水而浑浊,因此要干滤,使溶液澄清后,再测吸光度。
3)本方法测定含量为0.005%~0.5%(质量分数)的钒时线性良好,萃取后的络合物至少可稳定10min。
4)本方法中钒的氧化步骤至关重要。试样分析和校准曲线的操作条件应完全一致,每份溶液从氧化到萃取要逐个地操作,不要成批显色,除特别规定外,每一个操作步骤不要拖延。
4.二苯胺磺酸钠光度法
(1)方法提要 试样用酸分解,用高锰酸钾将钒氧化为五价状态,在尿素存在的情况下,以亚硝酸钠还原过剩的高锰酸钾。在硫酸介质中,钒(Ⅴ)氧化二苯胺磺酸钠而呈紫色,加磷酸抑制铁的影响,在波长530nm处测量吸光度。
本方法适用于钢铁中钒含量的测定,测定范围为0.05%~0.5%(质量分数)。
(2)主要试剂
1)硫磷混合酸:在700mL水中,加150mL硫酸,冷却后,加150mL磷酸,用水稀释至1000mL。
2)亚砷酸铵溶液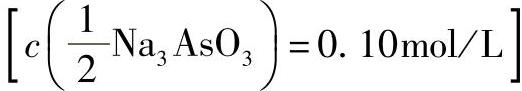 :在100mL水中,加入0.49gAs2O3、1.0g无水碳酸钠,加热溶解。
:在100mL水中,加入0.49gAs2O3、1.0g无水碳酸钠,加热溶解。
3)硫酸亚铁铵溶液[c(Fe2+)=0.05mol/L]:将2.0g硫酸亚铁铵[(NH4)2 Fe(SO4)2·6H2O]溶于少许水中,加5mL硫酸,冷却后用水稀释至100mL。
(3)分析步骤称取0.5000g试样置于200mL锥形瓶中,加20mL硫磷混合酸,加热溶解(或加王水溶解后再加硫磷混合酸),滴加2~3mL硝酸氧化,蒸发至冒白烟,冷却,用水溶解盐类,于容量瓶中稀释至50mL(铸铁试液可干滤)。
移取试样溶液[钒的质量分数小于0.5%时,移取2mL(相当于0.02g试样);钒的质量分数小于0.1%时,移取10mL]置于50mL容量瓶中,加20mL硫酸(1+1)、0.5g尿素,滴加高锰酸钾溶液(0.3%)至试液呈微红色,放置1~2min后,滴加亚硝酸钠溶液(0.3%)至红色消退,沿瓶壁加2~3mL亚砷酸钠溶液(0.10mol/L),再滴加2滴或3滴亚硝酸钠溶液(0.3%),加15mL磷酸(1+1),用水稀释至刻度,摇匀,冷却后,用移液管加1.0mL二苯胺磺酸钠溶液(0.05%),摇匀。
将溶液倒入2cm或3cm比色皿中,向剩余溶液中加数滴硫酸亚铁铵溶液(0.05mol/L),使紫色消退。以此作为参比溶液,在波长530nm处测定吸光度。
(4)校准曲线的绘制 称取不含钒或已知钒含量低的标样,按分析步骤溶解,稀释至50mL。从中移取试液七份置于50mL容量瓶中,分别加钒标准溶液(20μg/mL钒)0mL、1mL、2mL、…、6mL,按上述方法显色,测定吸光度并绘制校准曲线。每毫升钒标准溶液相当于钒质量分数为0.1%的试样0.02g(显色时)。
(5)附注
1)显色溶液中的硫酸含量应达20%,因为含量小时,灵敏度低,且稳定性也稍差;磷酸浓度应达到15%,因为磷酸能抑制铁的影响,但不能完全避免,磷酸含量少时,铁的干扰增大,空白溶液的色泽深。
2)钒的氧化还原电位随着磷酸的加入量增多而增高。在磷酸浓度高的溶液中,钒(Ⅴ)较易被过量的亚硝酸钠还原(过量5~6滴尚无碍),并且磷酸浓度高时,滴加高锰酸钾氧化及亚硝酸还原时,粉红色的明显程度都将降低。因此,磷酸在氧化还原后加入较为有利,但磷酸中不应有还原性物质存在。
3)锰的质量分数超过8%(按取样0.02g显色计)时,会使测定结果偏低。在不含磷酸的0.4~4.0mol/L硫酸溶液中,用高锰酸钾氧化钒时,铈无干扰。
4)在室内温度较高时,显色溶液的稳定性较差,宜在10min内测定吸光度。在15℃时,吸光度可稳定30min。
5)由于铁的空白,校准曲线不从“零”点开始。取样量不同时,校准曲线基本上平行移动。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




