锰在钢中的主要存在形式是MnS,有的也呈其他形式的化合物,如Mn3C、FeMnSi、MnSi、MnO、MnO·SiO2等。
锰在钢铁冶炼过程中,通常作为脱氧剂及脱硫剂而特意加入。锰与硫能形成熔点较高的MnS,可防止因FeS而导致的热脆现象,进而提高钢的可锻性。锰还能使钢的硬度和强度提高。
锰可溶解于稀酸(硝酸、硫酸、磷酸等)中,生成Mn2+。锰化合物性质也很活泼,容易溶解和氧化。锰是多价元素(2、3、4、6、7价),而且Mn(Ⅲ)、Mn(Ⅶ)化合物具有灵敏的紫红色,这些都是锰分析测定中的重要特征。
锰对化学分析的影响主要有两方面:一是锰含量高时,在低酸度介质中遇强氧化剂易产生棕色浑浊;二是锰含量高时,会使溶液中其他元素的氧化难以完全,如高锰钢中磷的氧化就是一例。
测定锰的方法很多,以硝酸铵氧化滴定法及高碘酸钠氧化光度法的应用最为普遍。这两种方法都具有操作简单、快速、准确、稳定的特点。此外,还有过硫酸铵氧化、亚砷酸钠-亚硝酸钠滴定法、过硫酸铵氧化、高锰酸钾滴定法、过硫酸铵氧化光度法、电位滴定法等。
1.高碘酸钠(钾)氧化光度法
(1)方法提要 试样经酸溶解后,在硫酸、磷酸介质中,用高碘酸钠(钾)将锰氧化至七价,测其吸光度。
本方法适用于生铁、铁粉、碳素钢、合金钢、高温合金和精密合金中锰含量的测定,测定范围为0.01%~2.0%(质量分数)。
(2)主要试剂
1)混合酸:取50mL硫酸、150mL硝酸溶液(1+1)、100mL磷酸混合。
2)不含还原物质的水:将去离子水(或蒸馏水)加热煮沸,每升水用10mL硫酸溶液(1+3)酸化,加几粒高碘酸钠(钾),继续煮沸约10min,冷却后使用。
(3)分析步骤 称取试样(锰的质量分数为0.01%~0.1%时,称取0.5000g;锰的质量分数为0.1%~1.0%时,称取0.2000g;锰的质量分数为1.0%~2.0%时,称取0.1000g),置于150mL锥形瓶中(或直接置于100mL两用瓶中),加15mL硝酸溶液(1+4),加热溶解(合金钢、高温合金和精密合金用王水或盐酸-过氧化氢溶解),加20mL混合酸(对于加盐酸溶解的试液,加入混合酸后冒烟处理),加水至约40mL,加10mL高碘酸钠(钾)溶液(5%),加热至沸,并保持微沸2~3min(防止试液溅出),冷却至室温,于容量瓶中用不含还原物质的水稀释至100mL。
将上述显色溶液移入比色皿中(锰的质量分数为0.01%~0.1%时采用3cm比色皿;锰的质量分数为0.1%~0.5%时采用2cm比色皿;锰的质量分数为0.5%~2.0%时采用1cm比色皿)。向剩余的显色液中边摇边滴加亚硝酸钠溶液(1%),至紫红色刚好褪去,将此溶液移入另一只比色皿中作为参比,于波长530nm处测量吸光度。
(4)校准曲线的绘制 用标准试样在相同条件下显色操作并绘制校准曲线。
(5)附注
1)溶解高硅试样时,可滴加3滴或4滴氢氟酸。
2)溶样时有盐酸参与的试液,一定要冒烟除尽Cl-,否则显色非常慢,且不完全。
3)本方法对铬含量较高的试样消除铬的干扰十分有效,因为Cr(Ⅲ)不被氧化为Cr(Ⅵ),至少不明显。Cr(Ⅲ)的绿色在530nm处几乎不吸收。因此,无需用高氯酸将Cr(Ⅲ)氧化为Cr(Ⅵ)后,再用高碘酸钠氧化锰。
4)钴含量较高的试样,如磁钢、铁镍钴合金等,CO2+也呈粉红色,会影响吸光度。因此,必须用亚硝酸钠将Mn(Ⅶ)的紫红色褪尽后作参比溶液,从而消除钴的干扰。
5)本方法在测定过程中,校准曲线的线性良好,也很稳定,对于锰含量较高(但质量分数小于6%)的试样,也可以采用分液显色的方法扩大测量范围。
6)溶液中加入磷酸是十分必要的。其作用是:
①与Fe3+络合成为无色的[Fe(PO4)2]3-。
②与Mn2+反应生成Mn3(PO4)2或H2[Mn(H2PO4)4],从而降低其氧化电位,使得Mn2+更容易被高碘酸盐氧化。
③提高高锰酸的稳定性,防止碘酸锰和过碘酸锰沉淀的生成。
2.过硫酸铵氧化光度法
(1)方法提要 试样用酸溶解后,在银盐(催化剂)存在的情况下,用过硫酸铵将锰氧化至七价,测其吸光度。
(2)主要试剂
1)硫磷混合酸:于700mL水中加150mL硫酸,冷却后,加150mL磷酸,用水稀释至1000mL。
2)定锰混合酸:每1000mL溶液中含0.1g硝酸银、12mL硫酸、15mL硝酸、15mL磷酸。
(3)分析步骤 称取0.5g试样,置于150mL锥形瓶中(或50mL两用瓶中)。
1)对于碳素钢、低合金钢的测定,加25mL硝酸溶液(1+3),加热溶解,煮沸,驱除氮氧化物,加10mL过硫酸铵溶液(15%),继续煮沸1~2min。
2)对于中合金钢、高合金钢、铸铁、高温合金的测定,加10mL王水(或用盐酸-过氧化氢),加热溶解,加5mL高氯酸,蒸发至冒白烟,维持1min左右,将铬氧化至高价。
3)对于钨钢、高速工具钢的测定,加20mL硫磷混合酸,加热溶解(或用王水溶解后加硫磷混合酸,滴加2mL硝酸氧化碳化物,蒸发至冒白烟)。
冷却,于容量瓶中稀释至50mL(铸铁试样可干滤)。从中分取5mL溶液,置于150mL锥形瓶中,加20mL定锰混合酸,加热至近沸,加5mL过硫酸铵溶液(15%),铬含量较高的试样可多加5mL,煮沸0.5~1min,冷却,于容量瓶中稀释至50mL。
将显色液倒入1~3cm比色皿中,于剩余溶液中滴加1~3滴亚硝酸钠溶液(0.3%)至紫红色褪去,以此为参比,在波长530nm处测定吸光度。
(4)校准曲线的绘制 称取纯铁数份,分别加入不同量的锰标准溶液(0.1mg/mL)。或称取不同锰含量的标准试样,按分析步骤操作,并绘制校准曲线。
(5)附注
1)对于含铬、钴的试样,必须滴加亚硝酸钠溶液或EDTA溶液(5%),使高锰酸紫红色褪去后作参比,以消除其干扰。碳素钢、铸铁试样可用水作参比。(https://www.xing528.com)
2)纯铁分析方法:称取0.5g试样,置于150mL锥形瓶中,加5mL硝酸溶液(1+3)、10mL硫磷混合酸、2mL磷酸溶液(1+1),加热溶解,加15mL水、1mL硝酸银溶液(1%),加热至近沸,加10mL过硫酸铵溶液(15%),煮沸0.5~1min。冷却,于容量瓶中稀释至50mL。将溶液倒入3cm比色皿中,于剩余溶液中加2滴或3滴亚硝酸钠溶液(0.3%),摇匀,使高锰酸的红色褪去,以此作参比,在波长530nm处测定吸光度。
同时,做一份试剂空白,并从测定结果中将空白试验测定结果减去。
试剂空白的吸光度一般为0.005A,原因可能是硝酸银被过硫酸铵氧化,生成银(Ⅲ)的络合物,溶于酸后形成棕黄色,日常分析中可以忽略。
3)过硫酸铵氧化时间为0.5~1min已足够,不必煮沸至冒大气泡。若煮沸时间太长,则吸光度会偏低。当硝酸银加入量少及酸度大时,这样的影响会更显著。但是发色后,取下稍加静置,再冷却,对显色完全与稳定是有益的。
3.硝酸铵氧化滴定法
(1)方法提要 试样经酸溶解后,在磷酸微冒烟的状态下,用硝酸铵将锰定量氧化至三价,化学反应式为
2MnHPO4+3NH4NO3+2H3PO4=2NH4MnH2(PO4)2+NH4NO2+2HNO3+H2O
过量的硝酸铵立即与产生的亚硝酸盐反应,反应式为
NH4++NO2-=N2↑+2H2O
反应中生成的亚硝酸盐完全分解,从而使二价锰氧化至三价锰的反应进行完全。然后,以N-苯代邻氨基苯甲酸为指示剂,用硫酸亚铁铵标准溶液滴定。
由于钒、铈也被定量氧化和滴定,因此会干扰测定,必须予以校正。
本方法适用于各类钢铁材料中锰含量的测定,测定范围为2.0%~3.0%(质量分数)。
(2)主要试剂
1)N-苯代邻氨基苯甲酸指示剂溶液(0.2%):称取0.2gN-苯代邻氨基苯甲酸及0.2g无水碳酸钠溶于水中,加热溶解,用水稀释至100mL,过滤后使用。
2)硫酸亚铁铵标准溶液[c(Fe2+)=0.020mol/L]:称取8.0g硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O],溶于300mL水及50mL硫酸中,冷却后稀释至1000mL。于溶液中放入纯铝片或纯铝线(可以将电缆铝线绕成弹簧状放入,铝线中应基本不含铁、锰),放置数天,使溶液中存在的少量Fe3+还原,然后用0.02000mol/L重铬酸钾标准溶液标定。溶液的浓度可以保持一个月以上。其标定方法如下:于150mL锥形瓶中,用滴定管或移液管加入20mL重铬酸钾标准溶液,加入30mL水、5mL硫酸溶液(1+1)、5mL磷酸溶液(1+1)、1滴或2滴指示剂,用硫酸亚铁铵标准溶液滴定至溶液由樱桃红色转为亮绿色为终点。
硫酸亚铁铵标准溶液浓度(mol/L)的计算公式为
式中 V——滴定所消耗硫酸亚铁铵标准溶液的体积(mL);
B——指示剂校正值。每滴指示剂约相当于0.02mol/L硫酸亚铁铵标准溶液0.04mL(mL)。
3)重铬酸钾标准溶液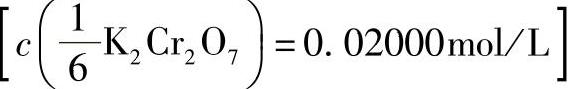 :称取0.9806g基准重铬酸钾溶解于水中,然后于容量瓶中用水稀释至1000mL。
:称取0.9806g基准重铬酸钾溶解于水中,然后于容量瓶中用水稀释至1000mL。
(3)分析步骤 称取0.1000~0.5000g试样(锰含量大于或等于10mg),置于200mL锥形瓶中,加25mL硝酸溶液(1+3)或10~15mL王水,加热溶解,加15mL磷酸[如果分析铸铁中锰的含量,则应先过滤,用稀硝酸溶液(2+98)洗涤3次或4次],继续加热至微冒烟并维持1min(此时溶液平静,无气泡),冷却约30s,立即加1.5~2g硝酸铵,不断摇动锥形瓶,并吹去氮氧化物。冷却至微温(50~70℃),加30mL稀硫酸溶液(1+9)(高铬钢加100mL),摇匀,冷至室温,用硫酸亚铁铵标准溶液滴定至微红色,加1滴或2滴指示剂溶液,继续滴定至由樱桃红色转变为亮绿色或绿黄色为终点。
(4)结果计算 锰的质量分数的计算公式为
式中 c——硫酸亚铁铵标准溶液的浓度(mol/L);
V——滴定所消耗硫酸亚铁铵标准溶液的体积(mL);
B——指示剂校正值。每滴指示剂约相当于0.020mol/L硫酸亚铁铵标准溶液0.04mL(mL);
54.94——锰的摩尔质量(g/mol);
m——称样量(g)。
(5)附注
1)本方法的测定结果为锰、钒(铈)的总量。试样含钒(铈)时,应减去校正值。1%钒相当于1.08%的锰;1%铈相当于0.39%的锰。
测定未知试样时,应检定钒(铈)。其方法为:在滴定锰后的溶液中,加50mL稀硫酸溶液(1+9)(已知100mL稀硫酸者不必补加),滴加3滴或4滴高锰酸钾溶液(1%),此时溶液呈红色,再加2g尿素,放置1~2min后,加5mL亚砷酸钠溶液(0.1mol/L),此时应保持指示剂为红色,必要时可补加指示剂。滴加6~8滴亚硝酸钠溶液(1%),放置1~2min后,用硫酸亚铁铵标准溶液滴定,终点由樱桃红转变为亮绿色(高铬试样的终点由暗绿色转为亮绿色)。在接近终点时,应降低滴定速度,逐滴加入。
滴定所消耗的硫酸亚铁铵标准溶液的体积,从上述滴定锰、钒(铈)含量的体积中减去,然后按公式计算锰的含量。
2)冒磷酸烟的目的是:驱尽其余各酸;控制氧化温度(磷酸沸点为213℃,发烟时可达250℃,但发烟时间不宜过长,否则会生成焦磷酸盐);磷酸是锰的良好稳定剂(生成MnPO4);磷酸的存在不使铬氧化(即使用高氯酸冒烟也不氧化),因此本方法中铬不干扰测定。
硝酸铵氧化锰的适宜温度为200~240℃。磷酸微冒烟时的温度约为250℃,冷却30s后(约在220℃)加硝酸铵氧化力最强,且再现性好。
3)冷却至微温时加稀硫酸较好。若温度太高时加稀硫酸,会因有亚硝酸盐还原而使测定结果稍偏低。但也不要冷却至室温再加,否则磷酸黏稠,加稀硫酸后盐类不易溶解,也不宜加热溶解盐类。做批量试样分析时,应适当增加磷酸用量,这样冷却至室温时,加稀硫酸后也容易溶解。单独滴定锰不受酸度影响,可以加水稀释。考虑到试样要检定钒,因此用稀硫酸稀释,以保证滴定终点灵敏。
4)对于铬含量高而锰含量小于3%(质量分数)的试样,最好先用高氯酸冒烟,加盐酸挥发铬,然后用亚硝酸钠还原铬,再加磷酸冒烟。本法也适用于锰铁中锰的测定。
5)有时出现终点泛红现象,其原因可能是:硝酸铵加入量过多,没有分解完全;滴定时温度稍高或滴定过快;锥形瓶上有黏附的Mn3+进入溶液。因此,滴定近终点时要放慢速度,放置0.5~1min不变色即可。
6)N-苯代邻氨基苯甲酸指示剂具有还原性,校正值按下述方法测定:于150mL锥形瓶中,用滴定管或移液管加入0.02000mol/L重铬酸钾标准溶液5mL,加20mL水、3mL硫酸溶液(1+1)、3mL磷酸溶液(1+1)、3滴指示剂,然后用硫酸亚铁铵标准溶液滴定至绿色为终点,另取一份重铬酸钾标准溶液,加1滴指示剂,同样滴定,两者所用硫酸亚铁铵标准溶液毫升数之差,即相当于2滴指示剂的校正值。通常每滴指示剂约相当于0.02000mol/L硫酸亚铁铵标准溶液0.04mL。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




