【摘要】:图7.4所示为AZ31合金和碳纳米管增强镁基复合材料在3.5wt%NaCl腐蚀介质中浸泡时腐蚀介质pH值随时间的变化曲线。配制的3.5wt%NaCl腐蚀介质为中性;在浸泡的初始阶段腐蚀介质,pH值迅速增加;浸泡1h后,pH值变化显著减慢。AZ31合金浸泡的腐蚀介质pH值进一步增加,而复合材料浸泡的腐蚀介质pH值基本保持稳定。
图7.4所示为AZ31合金和碳纳米管增强镁基复合材料在3.5wt%NaCl腐蚀介质中浸泡时腐蚀介质pH值随时间的变化曲线。配制的3.5wt%NaCl腐蚀介质为中性(pH值为6.95);在浸泡的初始阶段腐蚀介质,pH值迅速增加;浸泡1h后,pH值变化显著减慢。AZ31合金浸泡的腐蚀介质pH值进一步增加,而复合材料浸泡的腐蚀介质pH值基本保持稳定。
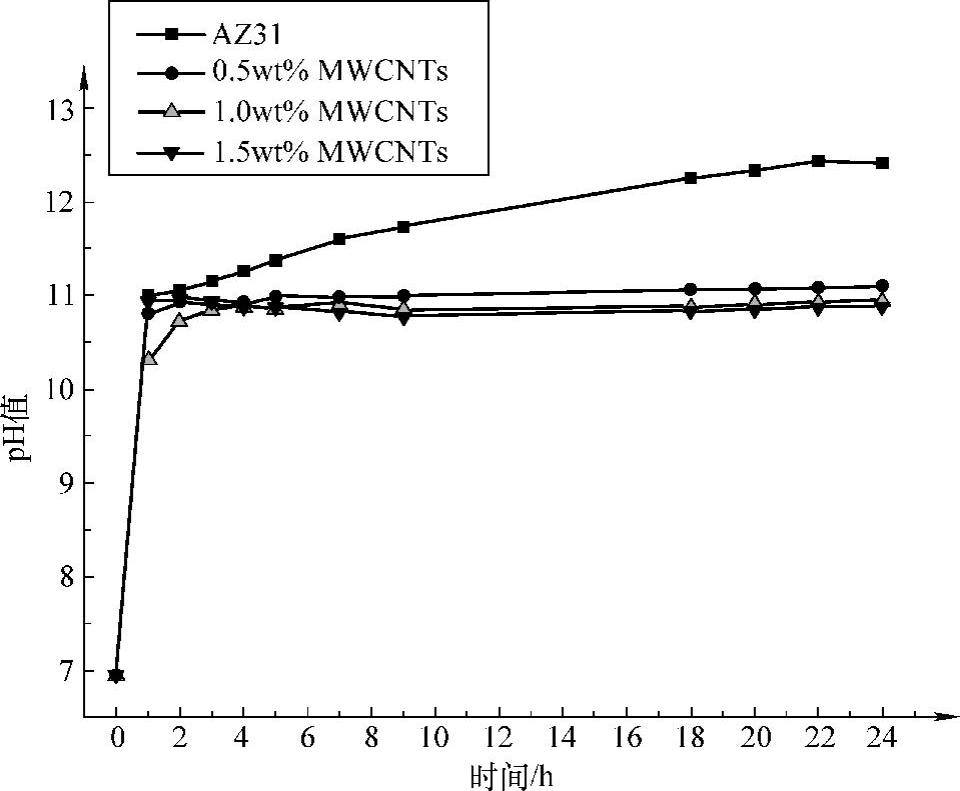
图7.4 AZ31合金和碳纳米管增强镁基复合材料在3.5wt% NaCl介质中浸泡时腐蚀介质pH值随时间的变化曲线
文献[158]指出,镁合金的腐蚀总是从镁基体相开始。镁基体(阳极)与内部合金相(阴极)之间在水溶液中就易发生电化学腐蚀,使基体金属溶解,反应式为:
阳极反应
Mg-2e=Mg2+ (6-1)(https://www.xing528.com)
阴极反应
2H2O+2e=H2↑+2OH- (6-2)
腐蚀反应
Mg2++2OH-=Mg(OH)2↓ (6-3)
腐蚀介质pH值会因腐蚀过程不断地产生OH-而上升,并随腐蚀速率加快而上升越快。图7.4描述了AZ31合金和MWCNTs增强镁基复合材料在3.5wt%NaCl溶液中浸泡时腐蚀介质溶液pH值随浸泡时间的变化。由图可以看出,当AZ31合金浸泡1h后,腐蚀介质的pH值已经达到11,之后pH值变化变缓,这是因为此时腐蚀介质中的Mg2+已经达到一定浓度,Mg2+与OH-生成Mg(OH)2沉淀,并且随着腐蚀过程的进行,沉淀也不断地产生,从而使介质的pH值变化变缓[159]。但对于复合材料,浸泡1h后腐蚀介质溶液pH值基本稳定不变,可见它的腐蚀速率远远小于AZ31合金。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




