生物类似药指的是在质量、安全性和有效性上与已获批注册的参考药物具有相似性的治疗用的生物制品,其研发有助于降低价格、提高生物技术药物的可及性,更好地满足公众对生物技术药物的需求。目前,生物技术药物已经在一些疾病的治疗中显示出明显优势,随着原研生物技术药物的专利到期及生物技术的发展,基于原研药的质量、有效性和安全性的生物类似药的研发已被全球多国政府重视,并纷纷制定了相关的指南。
为了在保证科学性的前提下合理地减少产品开发的技术要求,节约时间和经济成本,在生物类似药的仿制中占领先机,国家食品药品监督管理总局于2015年发布了《生物类似药研发与评价技术指导原则(试行)》,确定了生物类似药的监管框架,也勾勒出生物类似药研发与评价的决策图(图9-3)。在质量控制方面,该指导原则规定应采用先进的敏感的技术方法,对产品进行质量特性(包括理化特性、生物活性、纯度和杂质、免疫学特性)分析,建立合适的质量标准,并开展稳定性研究。
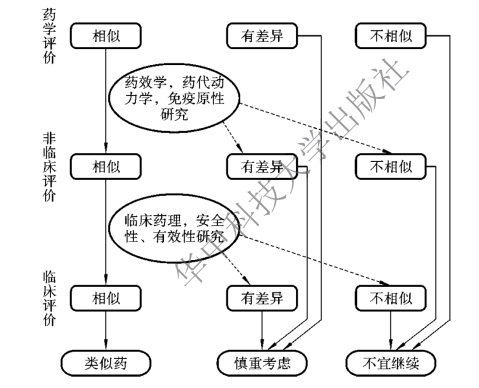
图9-3 生物类似药研发与评价的决策图
生物类似药的研发与评价的基本原则为以下四条。(https://www.xing528.com)
1.比对原则 研发过程中所进行的比对试验以证明参照药的相似性为主,证明候选药的质量、安全性和有效性。每个阶段的每一个比对试验均应与参照药同时进行,并采取相似的评价方法和标准。
2.逐步递进原则 研发中可采用逐步递进的顺序,分阶段证明候选药和参照药的相似性,并根据比对试验的研究结果对后续比对试验内容进行设计。若前一阶段比对试验结果存在不确定性因素,后续阶段中必须选择敏感的技术方法,有针对性地进行检测和评价。
3.一致性原则 比对试验所用的样品应当保持前后的一致性,候选药应当为生产工艺确定后生产的产品或其活性成分,对不同批次或者工艺、规模和产地等发生改变的候选药,应当评估这些变化因素对产品质量的影响,必要时需要重新进行比对研究。
4.相似性评价原则 如果全面的药学比对试验研究显示候选药与参照药相似,并在非临床阶段进一步证明其相似,后续的临床试验可以考虑仅开展临床药理学比对试验;如果不能证明充分相似,则需要开展具有针对性的研究或临床安全性、有效性研究,通过有针对性的敏感的技术和方法,确定其相似性。
进行生物类似药的评价时,应采用最先进的、敏感的技术和方法,且首先应当考虑采用与参照药一致的方法,来评价生物类似药的一些重要参数,包括生物活性、纯度、杂质等。选择生产表达体系、制剂处方、规格包装时,也应该尽可能与参照药一致,若不一致,应有充足的理由。生物类似药的质量相似性研究分析应贯穿整个研发评价过程,根据药物自身特点,结合多种方法,对生物类似药和参照药开展全面、充分的特征鉴定研究,以尽可能将检测不到的可能影响临床活性的差异的出现概率降到最低。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




