生物技术药物是蛋白质、核酸类药物,往往来源于活的生物体,结构比较复杂,在生产过程中涉及生物材料和生物学过程,存在固有的易变性,容易受到各种理化条件等的影响,而且相对而言,其生产过程中所使用的生物活性测定方法比物理化学测定方法的变异性大,加之方法学和检测灵敏度的限制,某些杂质在检定时可能检查不出来。因此,不仅在生产过程中需进行严格的质量管理,对于最终目标产品的质量控制也十分必要。
(一)生物技术药物的产品质量控制要点
1.生物活性测定 生物技术药物与传统化学药物不同,仅用物理化学方法检测无法完全反映其特性,因此需要一种或多种生物活性测定方法,来监测生物技术药物生产的各个阶段及最终产品的质量控制环节。生物活性测定就是测定生物活性物质效价的过程,由于生物技术药物的化学本质主要是多肽、蛋白质等,其活性主要由产品的氨基酸序列和空间结构决定,可以利用其特定的生物活性建立专门的效价测定体系,从而保证产品的药效。
生物活性测定可在体内或体外进行,最好能反映与临床潜在应用相关的信息,如动物模型上的生物活性测定与临床疗效的相关性较强。由于临床前试验的疗效和安全性可能不等同于临床试验结果,生物活性测定方法不是一定要与临床适应证直接相关,在实际生产工作中,可以采用经过方法学验证可行的实用的替代方法(简单替代复杂、体外替代体内、理化实验替代细胞培养等),但也要保证测定的准确性和不同批次产品之间的一致性。生物活性测定的方法必须采用国际通用的方法,用国际或国家标准品对测定结果进行校正,并以国际单位或指定单位标示,其测定结果必须进行统计学分析,说明与测定相关的不确定因素,在实际测定过程中,应尽量将与测定效价相关的误差降到最低。
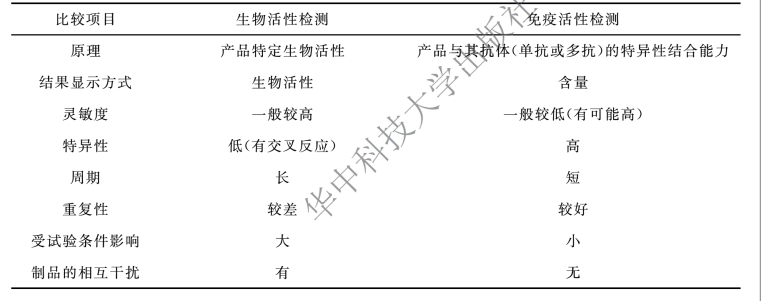
生物活性检测与免疫活性检测的比较见表9-4。
表9-4 生物活性检测与免疫活性检测的比较
2.蛋白质纯度和含量的测定 重组蛋白药物检测的两个重要指标为蛋白质纯度检查和蛋白质含量的测定。
蛋白质纯度检查必须用两种或两种以上不同原理的方法测定,通常为非还原型SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)和高效液相色谱法(HPLC),测定时应根据不同产品特点设定标准。剂量较小(如微克级)的产品(如细胞因子)的纯度检查通常在原液中进行,而剂量较大(毫克级或更高)的抗体类产品则需要对成品和原液都进行检测。一般重组蛋白药物的纯度应达到95%以上,某些药物的纯度需达到99%甚至更高。以下是部分蛋白质纯度测定方法的比较(表9-5)。
表9-5 几种重组蛋白纯度检定方法的比较

续表

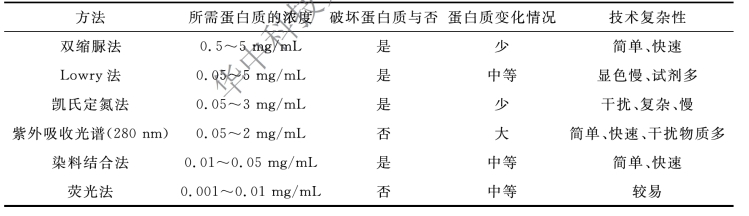
蛋白质含量测定主要用于原液比活性计算和成品规格的控制,准确测定蛋白质含量对于产品分装、比活性计算、残留杂质的控制等均有着重要意义。根据蛋白质的理化性质,有不同的含量测定方法可供选择,常用蛋白质含量测定方法的比较见表9-6。
表9-6 常用蛋白质含量测定方法的比较
3.理化性质的鉴定分析 理化性质的鉴定包括特异性鉴别试验、相对分子质量测定、等电点测定、肽图分析、吸收光谱、氨基酸组成分析、N端氨基酸测序、蛋白质二硫键分析等。
(1)特异性鉴别试验。
特异性鉴别试验的原理在于蛋白质的抗原性,根据抗原抗体特异性反应,可以建立免疫印迹、免疫斑点、ELISA等多种免疫学方法,若免疫电泳中出现两条及以上区带,可采用免疫印迹进一步鉴定。此外,抗体中和试验可以用于鉴别原液和成品,如干扰素具有抗病毒活性,若加入干扰素中和抗体,则其失去抗病毒活性,从而可以简便地检出干扰素。
(2)相对分子质量测定。
相对分子质量测定的常用方法包括还原型SDS-PAGE和质谱法。还原型SDS-PAGE中,蛋白质在还原型SDS和β-巯基乙醇存在的条件下形成表面带大量负电荷的杆状分子,大大降低分子形态和电荷对电泳中蛋白迁移率的影响,从而可以简便、快速、直观地测定蛋白质相对分子质量。但该方法有一定的最适测定范围,对相对分子质量大于10000的蛋白质的测定误差可能达到10%以上,对小蛋白或多肽的测定误差则更大。因此,在实际应用中,可用还原型SDS-PAGE测定大部分重组蛋白的相对分子质量,但对于小分子蛋白和多肽(如人表皮生长因子、重组水蛭素等)应采用质谱法测定其相对分子质量。质谱法测定相对分子质量准确、快速、重复性好、测定范围广,但成本较为昂贵。在某些生物技术药物的质量控制中,先采用质谱法对参比品进行准确的相对分子质量测定,但在样品的批放行检定中,采用SDSPAGE证明供试品与参比品一致,从而结合了两种方法的优点。
(3)等电点测定。
等电点测定是基于重组蛋白药物的等电点往往不均一的特性而设立的检测项目,这可能与蛋白质的构型改变、N端有无甲硫氨酸等情况有关,但是在生产过程中,批次之间的电泳结果应一致,从而反映其生产工艺的稳定性。等电点聚焦电泳法是常用的检测方法之一,成本较低。其原理为在两性电解质存在下,电泳胶形成一个pH梯度,蛋白质根据其等电点不同进行分离,到达等电点pH位置上即停止泳动,形成主区带。对于一些不易染色的蛋白(如重组人表皮生长因子等),可采用更加灵敏的毛细管电泳替代等电聚焦电泳法检定。
(4)肽图分析。
肽图分析指的是利用多种蛋白质定位裂解的手段和方法(如溴化氰化学裂解和胰蛋白酶裂解),将蛋白质断裂成固定大小的多个肽段,通过各种分离手段(如反相HPLC、质谱法等)分离并检测,从而对蛋白质一级结构做出较为精确的判断。在不能快速便捷地得到蛋白质一级结构的情况下,肽图分析能说明待测蛋白质与标准物质之间是否一致,是蛋白质类生物技术药物结构验证的重要手段,同时,同种产品批次之间的肽图的一致性也是工艺稳定性的验证指标。
(5)吸收光谱。
吸收光谱是基于某种重组蛋白有固定的最大吸收波长这一特性设立的检测项目。检测方法为以生理盐水为对照,在200~350 nm波长范围内对待检测样品的溶液进行扫描。由于测定方法存在误差,一般需要确定一个标准范围。同种产品不同批次之间的紫外吸收光谱应一致。但有的重组产品(如重组人脑利钠肽)的一级结构不含芳香族氨基酸,在280 nm处没有最大吸收峰,则不用做紫外吸收光谱检测。
(6)氨基酸组成分析。
氨基酸组成分析一般用微量氨基酸自动分析仪进行,通常先水解蛋白质(色氨酸用碱水解,其余氨基酸用酸水解),经自动进样后,通过柱前衍生法或柱后反应法分析氨基酸,并得出定量分析报告。待测样品的结果应与标准品一致,这一项目在试生产的头三批或工艺改变时应当进行。
(7)N端氨基酸测序。
N端氨基酸测序的基本原理为Edman化学降解法,一般要求至少鉴定N端15个氨基酸。对于单抗类生物技术药物,其第一骨架区可能相同,因此Edman技术很可能不能鉴别两个不同的单抗,例如VEGF单抗和抗HER2单抗不可通过Edman测序法进行有效鉴别。实际上,由于可以通过肽图等其他异质性分析方法对单抗进行有效鉴别,很多单抗类生物技术药物的质量标准中已不包含N端氨基酸测序。
(8)蛋白质二硫键分析。
蛋白质的二硫键与其生物活性密切相关,测定方法主要有简化的巯基试剂(DTNB)分光光度法等。一些生物技术药物的常规检定项目并不包含二硫键的分析,但在质量研究中,仍应该尽可能地分析清楚。对于二硫键比较多且复杂的产品,可结合比活性等其他检测项目,综合进行有效的质量控制。
4.残余杂质检测 残余杂质可能影响生物技术药物的生物活性而导致疗效下降,可能具有毒性而引起安全问题,也在一定程度上反映了生产工艺的稳定性,因此,有必要对产品的残余杂质进行检查。
残余杂质可以分为与产品相关的杂质和外来污染物两大类。与产品相关的杂质包括突变物、异构体、二聚体和多聚体、错误修饰物、错误裂解物或降解产物等,它们有可能被认为是活性成分,但也应监测,并规定允许的限度;更常见的杂质来源于外来污染物,包括热原、微生物污染、培养基中的成分、细胞成分(DNA、蛋白质等细胞组分)、生产和纯化过程带入的物质(如纯化亲和时所用的抗体、其他有机试剂等)。
在WHO有关规定和我国相关指南中,生物技术药物的原液和成品检定应当至少列入外源残留蛋白质、外源DNA等检测项目,同时,也建议对内毒素进行检测。测定残留蛋白质杂质的方法主要为双抗体夹心ELISA,测定内毒素时需采用固定厂家的鲎试剂盒和国家内毒素标准品。宿主细胞的DNA残留是重组产品中特有的潜在致癌物质,一般采用qPCR法进行检测,要求DNA残留限量在每一剂量中应小于100 pg。对于生产及纯化过程中带入的杂质,其限度规定应参考ICH对杂质的规定,原则上应有毒理学资料的支持。对于具有自我复制繁殖能力的烈性致病源污染,应采用生物学、生物化学、分子生物学、免疫学等方法进行多重检测,以保证产品安全性。总而言之,通过清除或者限制抑制杂质的含量,可以避免残留杂质所带来的特殊风险;建立标准化的操作流程,也有助于保证检测结果的可靠性和准确性。
5.安全性及其他检测项目
(1)无菌试验。(https://www.xing528.com)
无菌试验按照《中国药典》(2015年版)进行,注射用制品的菌检项目包括平皿法和滤膜法;口服或外用制剂的菌检项目包括需氧菌、厌氧菌、霉菌和支原体。随着微生物学技术的发展,制药领域还引入了一些快速微生物检测技术,开展快速微生物检测为有效期短的生物技术药物(如体细胞治疗产品、基因治疗产品等)检测提供了便利。
(2)热原试验。
热原试验一般按《中国药典》(2015年版)进行,采用家兔法,向每只家兔耳缘静脉注射人用最大量的3倍量药物,要求每只家兔体温升高不得超过0.6℃,3只的总和不得超过1.6℃。但对于生物活性高的细胞因子产品,可以考虑用内毒素检测替代家兔法。目前国际上已开展新型体外热原检测法(细胞法)的研究,用不同来源的单核细胞(如新鲜或冻存的人外周血单核细胞等)模拟人体,将其分别与热原标准品、待测产品进行孵育,通过检测热原的分泌量来反映生物技术药物的致热活性和热原污染情况。
(3)异常毒性试验。
异常毒性试验按照《中国药典》(2015年版)进行,目的在于检查生产工艺是否带入含有目标产品以外的有毒物质。常用小鼠和豚鼠进行异常毒性试验,且需要根据药品的生物学特性来确定注射量和注射途径。大多数重组产品本身已具有很强的生物活性,注射量过大有可能直接导致毒性反应。
(4)水分、装量、pH和外观检测。
水分、装量、pH和外观检测也可用于产品质量控制。生物技术药物的常见剂型为冻干粉针剂和液体针剂,两种剂型都应按《中国药典》(2015年版)进行pH检测;目前,常用Fischer法测定冻干粉针剂的水分,要求水分含量不得超过3.0%,而液体针剂的生物技术药物应设置装量试验。对于生物技术药物,可能存在特殊外观(如抗体或病毒载体的基因治疗载体),需根据产品特性来设置判断标准。
(二)基因工程疫苗质量控制标准示例
由于基因工程疫苗与传统疫苗相比,具有安全性好、生产规模大的特点,且对于无法进行细胞培养的病原体具有更加明显的优势,因此被越来越多地应用于疫苗的研发和生产之中。已上市药物的代表之一就是乙型肝炎疫苗。病毒样颗粒(VLP)疫苗特有的一项质量控制检测项目是效力试验,通过体外或体内利用表位清晰的中和性单抗与病毒颗粒的关键中和表位进行反应,可检测不同批次疫苗的有效性。同时,VLP的直径一般为纳米级,可以利用动态光散射(DLS)等方式测定VLP的大小,并追踪产品的一致性。乙型肝炎疫苗的质量标准见表9-7。
表9-7 重组(CHO细胞)乙型肝炎疫苗的质量标准

(三)基因治疗药物质量控制标准示例
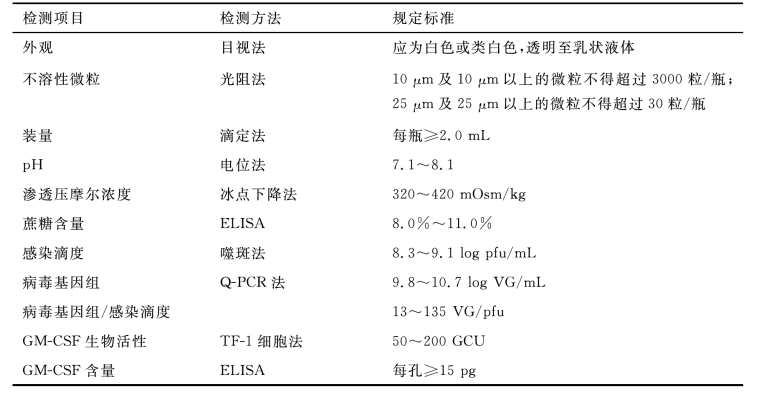
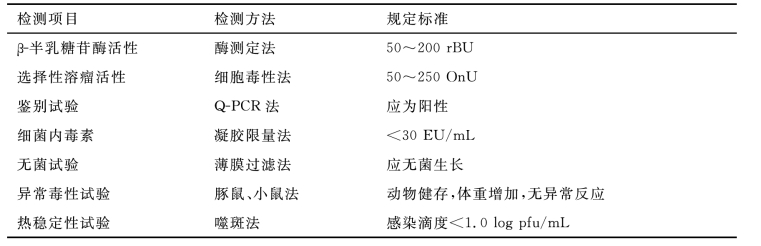
基因治疗药物通常指的是以脂质体、病毒、质粒DNA为载体,将核酸片段或基因序列导入人体细胞来达到治疗目的的药物。根据载体的不同和所引入基因的不同,基因治疗药物的质量控制重点和分析方法会存在较大差异。以溶瘤痘苗病毒为例,其质量标准见表9-8。
表9-8 溶瘤痘苗病毒JX-594的质量标准
续表
(四)单克隆抗体类药物质量控制标准示例
抗体相对分子质量较大,结构比较复杂,往往采用哺乳动物细胞表达体系制备,通常含有翻译后修饰,属于质量控制难度相对较大的生物技术药物。对于单克隆抗体的质量控制,需考虑多方法多角度地全面检测包括生物活性、结合活性、序列结构正确性、理化性质、修饰情况、纯度、杂质等在内的许多项目。对于近年来不断涌现的单克隆抗体类药物,需在药典规定的基础上,结合其自身属性建立相适应的质量控制方法和质量标准。几种不同的单克隆抗体类药物的质量标准见表9-9至表9-11。
表9-9 鼠源性单克隆抗体的质量标准

表9-10 人源化/嵌合单克隆抗体的质量标准

表9-11 尼妥珠单抗质量标准

续表

(五)基因工程药物质量控制标准示例
保证药物安全性和有效性是进行基因工程药物产品质量控制的主要目的。基因工程药物不同于一般的化学药物,它来源于活细胞,具有复杂的分子结构,涉及细菌发酵、细胞培养等生物学过程以及分离纯化等复杂的下游处理过程。基因工程药物具有固有的易变性和不确定性,因此质量控制对于基因工程药物来说至关重要。以重组人胰岛素为例,其原料与制剂的质量标准见表9-12。
表9-12 重组人胰岛素原料与制剂的质量标准

续表

(六)免疫细胞治疗制品质量控制参数考虑
随着生命科学技术的发展,人们已能够通过生物工程方法和/或体外扩增、基因改造、特殊培养获取具有特定功能的细胞,用于特异性增强免疫、杀伤肿瘤、促进组织器官再生等。近年来细胞治疗已成为生物技术药物研发热点,其中CAR-T治疗也为一些重大疾病或难治疾病提供了新的方法和思路。然而,细胞制剂的评价较为复杂,且有一定的特殊性,我国目前尚无完整成熟的质量控制规定。CAR-T治疗属于临床个性化治疗,但美国FDA与CFDA均已明确这类产品应按照药品注册处理。因此,为了保证CAR-T治疗的质量、有效性、安全性,需要参考国内外生物技术药物相关的法规和指导原则,从不同层次综合考虑,来形成对CAR-T治疗制品的合适的质量控制方法和质量标准(表9-13)。
表9-13 CAR-T治疗制品质量控制参数考虑

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




