(一)基因治疗
美国FDA对“基因治疗”的定义为“基于修饰活细胞遗传物质而进行的医学干预”。将外源的正常基因或者有治疗效果的基因导入靶细胞,在基因水平调控细胞中缺陷基因的表达,修补缺陷基因或用正常基因代替缺陷基因等,可用来干预由于基因缺陷所引起的遗传病、免疫缺陷病,以及原癌基因的激活或者抑癌基因的失活导致的肿瘤等疾病。也可以通过干扰或破坏病原微生物的基因表达,从而抑制或杀伤病原微生物来达到治疗或预防目的。
基因治疗的策略可大致分为两类,一类是基因的修正与置换,即对缺陷基因精确地原位修复,不涉及基因组的其他任何改变,其主要的技术手段是将外源正常的基因在特定的部位进行同源重组,从而使缺陷基因在原位特异性修复。另一类是增强基因的表达或者对基因进行失活改造,即通过导入外源基因从而补偿缺陷基因的功能,或特异性封闭某些基因的翻译或转录,以达到抑制某些异常基因表达的目的。
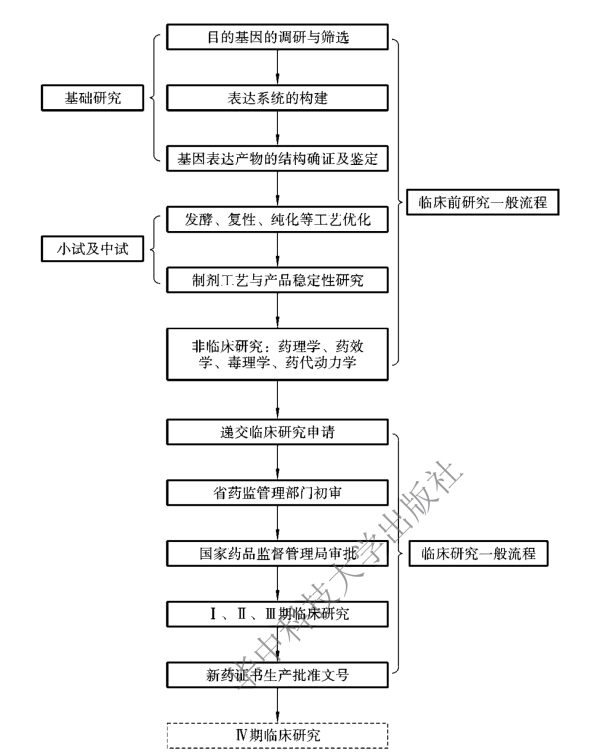
图9-1 生物技术药物研发审批一般流程
目前全世界已经有2000多个基因治疗方案进入临床试验,主要针对癌症、艾滋病、心血管疾病以及多种遗传性疾病。目前主要分为病毒载体基因治疗和非病毒载体类基因治疗。
1.病毒载体基因治疗 目前常用的病毒载体主要分为4种,慢病毒载体(LV)、腺病毒载体(ADV)、腺相关病毒载体(AAV)以及单纯疱疹病毒载体(HSV)。仙台病毒、新城疫病毒以及痘苗病毒等也有作为基因治疗载体的潜力。
慢病毒载体主要用于血液病的治疗,如β-地中海贫血症的治疗以及CAR-T免疫疗法。慢病毒载体也可以与CRISPR/Cas9技术相结合来应用于基因编辑,但由于CRISPR/Cas9在切割基因后存在载体自连问题,其成药性受到限制。
腺病毒载体的优势是其不整合进入宿主细胞的基因组,所携带的基因能达到较高的表达量;但腺病毒载体的表达时间较短且其病毒载体的免疫原性较强。腺相关病毒是一类单链线状DNA缺陷型病毒,不能独立复制,只有在辅助病毒(如腺病毒、单纯疱疹病毒、痘苗病毒)存在时,才能进行复制,否则只能建立溶源性潜伏感染。腺相关病毒主要应用于单基因遗传病的治疗,如血友病、LCA2型先天性黑蒙症以及脂蛋白酯酶缺乏症等。腺相关病毒外壳无外膜,无致病性,免疫原性弱,结构稳定,在70%的人群中天然感染且外源基因可以长期表达,甚至有一些血清型(如AAV9)具有能够穿过血脑屏障等的特点,但由于其可插入基因片段的容量较小,其应用受到了限制。但腺相关病毒在治疗单基因罕见病中仍然表现出巨大的潜力。
单纯疱疹病毒主要由Ⅰ型单纯疱疹病毒(HSV-1)改造而来,是双链线状DNA病毒。其由于细胞毒性较强且免疫原性强,主要用于实体瘤的治疗,如T-Vec。
2.非病毒载体类基因治疗 非病毒载体类基因治疗是指不通过病毒载体而以DNA药物、DNA疫苗或反义核酸药物等对活细胞遗传物质进行干预的治疗手段。随着人类基因组图谱的完善以及测序技术的进步,大量的潜在治疗靶点的基因序列被报道,同时核酸的合成与修饰技术的进步则为反义核酸药物提供了良好的发展条件。在2011年,一种编码重组血管内皮因子基因的质粒DNA治疗药物作为第一个非病毒载体基因药物在俄罗斯上市;2016年,一种反义RNA药物被美国FDA批准上市,用于治疗杜氏肌营养不良;同样是在2016年,美国FDA还批准了一种反义寡核苷酸药物用于治疗儿童与成人的脊髓性肌萎缩。
国家药品监督管理局批准了携带编码重组人干细胞生长因子的质粒基因治疗药物进入临床研究,用于治疗肢端缺血。我国在反义寡核苷酸基因治疗药物上也有所突破,以端粒酶hEST2为靶点的反义寡核苷酸抗肿瘤药已经进入临床前研究。
(二)基因工程抗体
基因工程抗体又称重组抗体,即根据不同目的,采用基于工程的方法在基因水平对免疫球蛋白进行切割、拼接或修饰,并利用细胞表达所产生的新型抗体。基因工程抗体主要包括嵌合抗体、人源化抗体、单链抗体、双特异性抗体等。
1.嵌合抗体 嵌合抗体是最早制备成功的基因工程抗体,是利用DNA重组技术,将鼠源抗体的V区基因与人源抗体的C区基因拼接为嵌合基因,插入表达载体并转入适当受体细胞表达而成的抗体。这样的抗体既保留了亲本鼠源抗体对抗原的识别与结合能力,又降低了其作为异源抗体的免疫原性。
嵌合抗体构建的简要流程:首先克隆鼠源抗体的可变区,然后将其连接到含有人源抗体恒定区基因表达的载体上,最后转入哺乳动物细胞中进行表达。
2.人源化抗体 嵌合抗体分子的60%~70%是人源的,但因其重链可变区来源于鼠,仍然有能力引发免疫反应。为了降低抗体的免疫原性,使其得到更好的应用,基于互补性决定区(complementarity determining region,CDR)的移植技术的抗体得到开发。CDR在空间结构上可与抗原表位形成精密的互补结构。因此,抗体可变区的CDR能够直接决定抗体的特异性,而CDR移植技术就是将鼠源抗体的CDR移植至人源抗体可变区,使人源抗体获得鼠源抗体的抗原结合特异性。该类抗体称为改型抗体或人源化抗体,具有鼠源抗体的特异性与人源抗体的功能。
人源化抗体的构建流程:以人源抗体基因序列为骨架,以鼠源抗体的CDR序列置换人源抗体序列。全合成法是将可变区的两条序列分为若干片段且相邻片段有彼此的黏性末端,在此基础上合成所有片段并逐一连接到完整的可变区,再将片段插入质粒,即可用于人源化抗体的表达。定点突变法是将人源抗体的可变基因克隆出来,再根据鼠源抗体中的CDR序列合成对应的突变引物,以点突变的手段将鼠源抗体CDR序列替换人源抗体的CDR序列,将改造的CDR序列插入质粒,即可用于人源化抗体的表达。
3.单链抗体(single chain Fragment variable,scFv)scFv是利用DNA重组技术将抗体重链可变区和轻链可变区通过长度为15~20个氨基酸的短肽基因序列连接后表达得到的抗体片段。scFv的制备包括scFv的基因表达载体构建与重组scFv的表达,单链抗体的制备关键是得到可变区的基因序列,根据抗体骨架区FR-1与FR-4的碱基组成和顺序分别合成抗体重链可变区和轻链可变区基因的PCR引物,扩增得到抗体重链可变区和轻链可变区的基因,之后用限制性内切酶进行酶切连接或用重叠延伸拼接法将两者连接成scFv基因并在大肠杆菌中表达。
4.双特异性抗体(bispecific antibody,BsAb)双特异性抗体是含有2种特异性抗原结合位点的融合抗体。之前对双特异性抗体的研究主要集中于将一个特异的抗原与效应细胞连接起来,例如,一个双特异性抗体能够特异性地识别并结合肿瘤细胞上的抗原,同时它也能识别并结合T细胞上的CD3抗原。这样,双特异性抗体能在靶细胞(肿瘤细胞)和功能分子(效应细胞)之间架起桥梁,激发具有导向性的免疫反应。最近的一些研究发现,双特异性抗体能同时结合两个疾病相关的靶抗原,其阻滞以及中和作用也都增强了,这在一定程度上解决了单克隆抗体药物单一靶点治疗中可能出现的代偿现象。
5.基因工程抗体发展趋势 抗体作用的机制比较明确,所以其作为药物开发的优势很明显且成药的概率较高。最新数据显示进入临床研究以及获得国家药品监督管理局批准的抗体药物数量再创新高;全球共有570多种抗体药物处于不同的临床研究阶段,其中62种处于后期临床研究阶段;抗体药物从Ⅰ期临床试验直至批准上市的成功率较高,根据应用领域的不同,成功率可达到17%~25%。
(1)抗体-药物偶联物(antibody drug-conjugate,ADC)。
抗体-药物偶联物是指以共价键连接的方式将具有生物活性的小分子药物连接到单克隆抗体上构建而成的药物。通过此类修饰,抗体-药物偶联物既具有单克隆抗体对抗原特异性结合的能力,也有小分子化合物广泛的生物活性。这一优势使得抗体-药物偶联物成了抗体药物研究的热点。目前全球已有4种抗体-药物偶联物产品上市,国内目前并没有抗体-药物偶联物产品上市,但已有多家企业布局,截至2018年8月,我国已有18家企业申请了16个抗体-药物偶联物相关产品开展相关临床试验。
(2)三功能抗体(trifunctional antibody,TriomAb)。
三功能抗体除了有两个不同的抗原结合位点之外,还有完整的Fc片段,其两个抗原与双特异性抗体的选择类似。而完整的Fc片段可以结合具有Fc受体的作用细胞,如单核巨噬细胞、自然杀伤细胞、树突状细胞等作用细胞,与CD3介导的T细胞一起作用于肿瘤,提高对肿瘤的杀伤力。
(3)新靶点、结构、表位抗体。
越来越多的新抗体药物进入临床研究,2014年9月美国批准程序性死亡蛋白-1(PD-1)单抗上市,用于治疗不可手术的黑色素瘤。肿瘤微环境中PD-1通路持续激活,T细胞功能被抑制,无法杀伤肿瘤细胞。PD-1的抗体可以阻断这一通路,部分恢复T细胞的功能,使这些细胞能够继续杀伤肿瘤细胞。而抗体药物的作用范围也不仅仅局限于代谢、肿瘤、炎症以及免疫细胞等方面,针对高血脂、骨质疏松、阿尔茨海默病等疾病的抗体药物也在研发当中。
(三)基因工程疫苗
疫苗传统的概念是指将病原微生物及其代谢产物通过人工减毒等方法制备,用于预防传染病的免疫制剂。基因工程疫苗是指采用基因工程技术,克隆表达保护性抗原基因并将其表达的抗原产物用于疫苗的制备。
1.疫苗的发展“疫苗之父”巴斯德运用物理、化学、微生物学等方法,以降低其毒力为目的来处理病原微生物,并以低毒的病原微生物接种到人体,用来预防烈性传染病,这便是疫苗最初的发展历程。卡介苗是减毒活疫苗的实例,科学家将一株牛型结核分枝杆菌在离体培养基中连续培养200代以上,历经13年得到了减毒的卡介苗。1928年卡介苗开始在全世界范围广泛使用。20世纪初期研制的卡介苗、炭疽杆菌疫苗、狂犬病疫苗拯救了无数生命,使得这些烈性传染病得到了控制。
20世纪70年代开始,分子生物学技术的突破使得疫苗研究得到飞速发展。传统方法难以获得大量以及高纯度的抗原进行研究和生产,而基因重组技术则可以提供充足的试验原料,并且基因重组技术使得病原微生物的研究更加安全。乙肝疫苗的成功是基因重组疫苗重要的一个里程碑,1986年成功通过基因工程技术制备了乙型肝炎表面抗原,并最终作为乙肝疫苗应用于临床。
21世纪初,基因组学与蛋白组学的进步使得科学家可以从全基因水平来筛选具有保护性免疫反应的候选抗原。大规模、高通量、自动化以及计算机分析的研究方式能够在短时间内完成大量候选抗原的筛选工作。
2.疫苗的研究进展
(1)核酸疫苗。
核酸疫苗的出现与发展在疫苗的发展史上有重要的意义,1991年Williams等发现外源基因输入体内的表达产物可以诱导免疫应答。之后,大量的研究表明在适当的条件下接种DNA能够产生细胞免疫与体液免疫,此类DNA疫苗在1994年被命名为“核酸疫苗”。
(2)治疗性疫苗。
治疗性疫苗是指针对已感染疾病或已患病的机体,通过注射疫苗以诱导特异性的免疫应答,从而达到治疗或防止疾病恶化的目的。近年来,国外部分针对肿瘤的治疗性疫苗已进入临床研究阶段,而肿瘤治疗性疫苗的来源包括肿瘤细胞自身、肿瘤细胞裂解物、纯化的相关蛋白、合成的蛋白多肽等物质或是含有肿瘤抗原基因的病毒或质粒载体等。例如法国研发的用于治疗非小细胞肺癌的疫苗在Ⅱ期临床试验有着出色的表现,可延长不吸烟或是较少吸烟的患者生存期2.5倍左右。
随着生物技术的发展,预计在21世纪,联合疫苗、可控缓释疫苗、偶联疫苗、DNA疫苗、治疗性疫苗等的技术将会有较大的进展。
3.疫苗研究所面临的困难 禽流感、病毒性肝炎、艾滋病等传染病仍然威胁着人类的健康,而疫苗的研制与改进是人类预防传染病最有效的手段,但疫苗的研制面临着某些疾病的机制尚不明确、疫苗的研发周期长、疫苗产业化需要较大量资金等问题。
(四)重组蛋白
重组蛋白是应用DNA重组或RNA重组技术获得的蛋白质。随着基因组学与蛋白组学的发展,未来将会有越来越多的功能基因被克隆和表达,相应重组蛋白的种类和数量也会更加丰富。
(1)目的基因的获得与功能研究。
目的基因可以是新功能基因,或是对已发现的基因进行改造后的基因。而基因功能研究包括对相关的调控基因、编码的蛋白的理化特性的研究以及对相应动物模型的研究。基因可以通过不同的克隆方法以及全合成的方式获得。基于人类基因组计划的结果,对测得的序列进行功能分析也显得尤为重要,通过大量的筛选以及验证后,可确定疾病相关的基因作为研究对象,开发对某种疾病有治疗或者抑制作用的蛋白药物。
(2)目的基因的鉴定。
在重组蛋白药物的研究中,基因信息与基因功能的资料也较为重要。开发者或研究者需要对所有与目的基因获得相关的原始资料进行保存,例如引物的设计、模板的选取、酶切位点、相关电泳图、载体的选用以及构建的示意图等。此外,还需要将克隆得到的片段与数据库中的参考序列进行同源性比较。(https://www.xing528.com)
(3)表达载体的筛选与构建。
筛选表达载体的目的在于,在保留目的蛋白的生物活性的同时提高目的蛋白的产量。此外也需要从其复性、纯化等工艺的复杂程度、培养的难度以及成本的高低等多方面综合考虑。
(4)表达系统。
大肠杆菌表达系统是较为成熟的表达系统,适合表达非糖蛋白以及二级结构较为简单的蛋白质,产物大多是包涵体,需要经过复性。酵母表达系统适用于表达大量蛋白质与部分糖基化蛋白,产物一般分泌到胞外,其主要的优势在于作为真核表达系统,比哺乳动物类细胞表达系统更容易实现高表达。哺乳动物类细胞表达系统适用于表达糖基化蛋白或者空间结构较为复杂的蛋白,可在构建载体时在目的蛋白前端加一段信号肽,产物便能够被运输到胞外。其他表达系统还包括芽孢杆菌、丝状真菌、昆虫细胞、CHO细胞等,重组蛋白也可以利用转基因动物的乳腺或者植物产生。
(五)多肽药物
多肽药物可用于对疾病进行预防、治疗和诊断。多肽是指氨基酸通过肽键相互偶联而形成的一类化合物,其本质是蛋白质,常将10个以下氨基酸缩合而成的多肽称为寡肽,将相对分子质量不大于10000或氨基酸数目不大于50的肽链称为多肽,将相对分子质量大于10000或氨基酸数目大于50的肽链称为蛋白质。自然界中存在大量具有生物活性的多肽,它们参与多种生理过程的调节,涉及分子识别、信号转导、个体发育和细胞分化等过程,被广泛运用于多种疾病的治疗。药用多肽大多源于体内内源性肽或天然多肽,结构清楚且作用机制相对明确,可进行进一步修饰和改造,具有极大的开发潜能。
1.多肽药物的种类 目前研究和开发较多的多肽药物主要有靶向多肽/穿膜肽、抗肿瘤多肽、抗菌活性肽、抗代谢性疾病多肽、多肽疫苗、细胞因子模拟肽、诊断用多肽等。
(1)靶向多肽/穿膜肽。
靶向多肽/穿膜肽是目前多肽研究领域的热点,主要指通过噬菌体展示库技术等大规模筛选所获得的在某类细胞特异性聚集或与某种分子特异性结合或特异性穿透磷脂双分子层的一类多肽。靶向多肽/穿膜肽一般不单独成药,而是作为辅助工具与其他多肽药物杂合或与小分子偶联,从而将药物导向作用部位,同时可减弱其毒副作用。
(2)抗肿瘤多肽。
目前针对抗肿瘤多肽的研究主要集中于筛选可特异性结合与肿瘤发生、发展、增殖和转移密切相关的调控基因/分子的多肽,从而阻断参与肿瘤增殖、转移等关键过程的信号通路,诱导肿瘤细胞凋亡,进而发挥相应的抗肿瘤作用。
(3)抗菌活性肽。
抗菌活性肽是一类具有抗菌活性的多肽,相对分子质量为2000~7000,多由20~60个氨基酸组成,包括天然抗菌活性肽和人工合成活性肽。抗菌活性肽多具有强碱性、热稳定性以及广谱抗菌等特点。
(4)抗代谢性疾病多肽。
近年来,代谢性疾病相关多肽研究火热,已发现多种多肽能发挥多种作用,如刺激胰岛素分泌、抑制胰高血糖素分泌、促进瘦素产生和增强骨骼肌功能等,其代表性例子包括普兰林肽和胰高血糖素样肽1等,可用于多种代谢性疾病的治疗。
(5)多肽疫苗。
多肽疫苗是按照病原体抗原基因中已知或预测的某段抗原表位的氨基酸序列,通过化学合成技术制备的疫苗。多肽疫苗通常不存在毒力回升或灭活不全的问题。
(6)细胞因子模拟肽。
细胞因子模拟肽指通过筛选得到的能与细胞因子受体特异性结合,发挥细胞因子活性的一类多肽,其序列通常区别于传统细胞因子。
(7)诊断用多肽。
诊断用多肽一般源自致病体或肽库筛选,用于检测体内是否存在病原微生物、寄生虫等的抗体。目前常用的诊断用多肽多针对肝炎病毒、人类免疫缺陷病毒等抗体的检测。
2.多肽药物目前主要面临的问题
(1)体内不稳定性。
多肽药物进入体内后容易被血浆和胃肠道中的蛋白酶水解成片段肽或氨基酸,同时在体内可产生如吸附、聚集和沉淀等物理变化以及氧化、水解、消旋、糖基化等化学变化,从而降低了多肽药物的半衰期,并影响其活性。
(2)免疫原性。
许多多肽药物是通过人工筛选、合成而得到的,并非在体内天然存在,因此其相对于机体属于外源性物质,能够作为抗原刺激特定的免疫细胞,使免疫细胞活化、增殖、分化,最终产生免疫效应物质抗体和致敏淋巴细胞,使机体产生不良反应,如过敏反应,对机体造成损伤,从而限制了多肽药物等大分子药物的使用。
3.多肽药物开发策略
(1)化学修饰。
合适的化学修饰方法可增强多肽药物的活性,提高其热稳定性,并帮助抵抗蛋白酶降解,从而延长其半衰期。目前运用最广泛的化学修饰剂为单甲氧基聚乙二醇(m-PEG),其次为多糖类如葡聚糖、聚蔗糖,近年来利用长链脂肪酸或聚烯属羟基化合物对多肽药物进行修饰也是研究热点方向。以研究较为成熟的PEG化修饰为例,m-PEG以共价键方式与多肽连接,对多肽表面的氨基进行修饰,可有效改变药物在体内的分布和药效学特性。PEG化修饰后多肽的半衰期可延长几倍到几十倍,同时多肽的免疫原性有部分降低,溶解性也有所改善。
(2)基因融合。
基因融合技术可增大多肽药物的相对分子质量,改善其与受体的亲和性。目前针对多肽药物最常采用的基因融合方式为将其与人血清白蛋白(HSA)融合。人血清白蛋白是天然的载脂蛋白,具有较大的相对分子质量(约66000),无免疫原性且生物相容性较好,半衰期达两周。1990年,英国便首次将人血清白蛋白与多肽药物相融合以提高多肽药物半衰期,临床数据表明该融合蛋白的体内清除速率降低了近50倍。
(3)制剂手段。
剂型的选择、制剂方法的优化等也是多肽药物二次开发常用办法。目前针对多肽药物脂质体的开发较为成熟,已有米伐木肽脂质体、谷胱甘肽脂质体和多种脂质体流感疫苗上市。PLGA微球是另一种研究较为成熟的缓释载体,负载药物后可实现数天甚至数月的药物持续释放,目前以PLGA为载体的药物如艾塞那肽微球、奥曲肽微球、亮丙瑞林微球等多个产品均已上市销售,其市场效应不亚于实体分子。近年来,植入剂型也有了一定的发展,可实现对多肽药物的缓、控释放,且均占据了一定的市场份额。
(六)长效类蛋白药物
除部分抗体药物外,蛋白药物的相对分子质量一般小于50000,因而肾小球滤过率较高,体内稳定性差,容易被各种酶剪切或降解,造成其血浆半衰期短。为了确保药物疗效,在临床应用中只能通过增加使用频次和加大使用剂量来达到治疗目的,增加了患者的身体负担和经济负担,且容易引发系列不良反应。为了延长蛋白药物的半衰期,长效类蛋白药物应运而生。长效类蛋白药物指通过化学修饰、基因融合或制剂手段等方法对蛋白药物进行改造而得到的一类半衰期较长、免疫原性较低的新型蛋白药物。
1.化学修饰 目前通过化学修饰对蛋白药物进行长效改造已发展成一种相对成熟的手段,常用的修饰手段主要有聚乙二醇(PEG)化修饰、饱和脂肪酸修饰、聚烯属羟基化合物修饰和多糖类修饰等,其中PEG化修饰运用最为广泛。PEG类修饰剂具有高度的亲水性和水溶性,无毒性,无免疫原性,可在体内自行降解,PEG以形成共价键的方式与蛋白质表面的氨基进行偶联,可有效改变蛋白药物在体内的分布和药效学特性,如降低其肾脏清除率、免疫原性和抵抗蛋白酶降解等。目前PEG化修饰已运用于40多种蛋白药物的修饰,如猪血清白蛋白(PSA)、肿瘤坏死因子α(TNF-α)、白介素-2(IL-2)等,其中数十种已上市销售,如用于治疗类风湿性关节炎和克罗恩病的PEG-TNF-α抗体Fab段、针对肾病引发贫血的药物PEG-EPO、治疗肢端肥大的药物PEG-生长激素拮抗剂等。PEG化修饰技术虽然成熟,但也暴露出一定的缺点。如PEG在体内降解生成的低相对分子质量产物具有潜在的肾脏毒性,同时PEG化修饰可能引入杂质,增加了纯化和制剂的生产投入。此外,PEG化修饰的使用具有一定的局限性,部分蛋白修饰位点不能充分暴露,造成极低的产率,部分蛋白修饰后发生构象变化从而影响其活性。
2.基因融合技术 基因融合技术主要通过DNA重组技术,将效应蛋白和分子伴侣进行基因重组后再进行表达,从而获得全新的重组蛋白。基因融合类蛋白药物主要依靠分子伴侣的长效机制,增加蛋白药物的相对分子质量,降低肾脏的清除率,从而延长蛋白药物的半衰期。相比PEG化修饰,通过基因融合技术改造蛋白更加灵活简便,且获得的产物产量较大、纯度更高。此外,基于蛋白作用的构效关系,可将基因融合技术与定点突变技术等结合,对蛋白药物进行更加全面、合理的设计。目前常见的融合蛋白药物有Fc融合蛋白和HSA融合蛋白两大类。其中,Fc融合蛋白技术是目前研究最多、发展最快的蛋白融合技术,融合对象涉及配体蛋白、受体结构域和多肽等。Fc片段属于免疫球蛋白G保守区的一部分,由Hinge、CH2、CH3组成,包含启动ADCC、CDC的功能域及延长其半衰期的FcRn结合域。在pH<7的内涵体中,抗体与FcRn结合,在其介导作用下,抗体回到细胞外于中性条件下与FcRn解离,避免了抗体进入细胞后直接从溶酶体降解的风险,从而实现长效的目的。蛋白药物Fc融合后可抵抗降解,延长半衰期,目前已有多种Fc融合蛋白药物上市销售。
(七)干细胞、免疫细胞和组织工程
1.干细胞 干细胞(stem cell)是一类具有自我复制能力且具有分化潜能的细胞。原始的未分化的干细胞在一定条件下可以分化成细胞,如心肌细胞、神经细胞、血细胞等。干细胞技术是近年发展起来的高新技术,因干细胞高度的可塑性,其在组织器官移植、细胞治疗、组织工程以及新药筛选等方面的应用,成为生命科学领域研究热点之一。
人体几乎所有组织都存在成体干细胞,如果不加以外界干预,成体干细胞会倾向于分化成该组织的各类细胞,如造血干细胞在体内会分化成不同的血细胞。而在特定的条件下,一种成体干细胞可以分化为其他组织的功能细胞,如造血干细胞可以在特定条件下分化为肝细胞。近年来,干细胞是如何分离纯化成体干细胞以及干细胞“横向分化”的原理已成为研究热点。
我国已有超过30年的干细胞研究历史,目前已经有一定的研究基础。造血干细胞、胚胎干细胞、克隆性治疗以及组织干细胞等方面的研究与应用已大量展开,在定向诱导、分化调控、组织干细胞分离等方面取得了一定进展。为更好地促进干细胞的研究并为研究提供指导,国家卫计委、国家食品药品监督管理总局于2016年成立专家委员会,并颁布了《干细胞制剂质量控制及临床前研究指导原则(试行)》。
2.免疫细胞 免疫细胞是指参与免疫应答或与免疫应答相关的细胞,包括淋巴细胞、树突状细胞、单核巨噬细胞、粒细胞、肥大细胞等。免疫细胞可以分为多种,在人体各组织中担任重要角色。
免疫细胞治疗的主要原理是将患者的免疫细胞在体外经过细胞因子或肿瘤相关抗原处理后,经过扩增纯化再回输到机体,以期发挥免疫治疗的作用。有部分研究以肿瘤组织直接制备瘤苗,在某些疑难疾病的治疗中也显示出较好的效果。目前我国已有针对自体免疫活细胞、自体树突状细胞、自体CIK细胞等十余个细胞治疗产品进入临床和申报阶段。
CAR-T免疫疗法是近年发展较为迅速的细胞治疗技术,包括采血、T细胞分离、激活与扩增、感染CAR、质控、回输等步骤。Kymriah和Yescarta是两种嵌合抗原受体CAR-T新药物,分别被美国FDA批准用于治疗3~25岁复发或难治性急性淋巴细胞白血病和非霍奇金淋巴瘤。
3.组织工程 组织工程这一术语在1987年被美国国家科学基金委员会确定。组织工程学指根据细胞生物和工程学的原理,将具有特定生物活性的组织细胞与生物材料相结合,在体外或体内构建组织和器官,以维持、修复、再生或改善损伤组织和器官功能的一门学科。1991年科学家将软骨细胞与可降解材料相结合并在裸鼠体内形成新的软骨组织;1994年研究者以PGA塑型的载体结合软骨细胞,获得半透明的软骨;1997年,科学家利用半透明软骨在裸鼠的背上制备了人耳形耳廓;2007年,由我国研究人员开发的ActivSkin被国家食品药品监督管理总局批准成为中国首个组织工程学产品,标志着中国成为世界上第二个拥有人工皮肤技术的国家;2010年我国科学家开发的一种骨修复支架获得批准。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




