(一)目的基因的获得与重组载体的构建
目的基因HSA是人工合成的,在其5'端和3'端分别加上了SchⅠ和XhoⅠ酶切位点,并在目的基因的上游添加一段1241 bp长的Gt13a启动子和信号肽序列(GenBank:AP003256)。该序列是从水稻基因组TP309中获取的,这样可以充分利用水稻基因密码子的偏好性来有效表达HSA基因。
农杆菌双元载体将合成的HSA基因用Sch Ⅰ和XhoⅠ双酶切,并克隆进经NaeⅠ/XhoⅠ酶切的质粒pOsPMP0 1,得到重组质粒pOsPMP04。同时,为了构建根瘤农杆菌双元载体,用Hind Ⅲ和EcoR Ⅰ双酶切pOsPMP04,将得到的2832 bp的片段克隆进双元载体pCambia1301,得到的重组载体命名为pOsPMP0114,并将其导入根瘤农杆菌EHA105中。
(二)农杆菌介导的共转化
将pOsPMP114和pOsPMP2通过农杆菌介导转化从水稻品种TP309中分离得到的愈伤组织。
(三)共转化的检测
用PCR方法鉴定成功转化的愈伤组织。
PCR程序:94℃变性5 min,随后,进行94℃30s,58℃30s和72℃45s,共30个循环。所有PCR阳性植株在温室中培育至成熟。
(四)OsrHSA的定量测定
在提取液(50 mmol/L Tris(pH 8.0),100 mmol/L NaCl)中研磨种子,12000g离心10 min取上清液,得到水稻种子蛋白粗提液。其中,蛋白浓度用BCA方法测定。HSA的定量检测用人HSA ELISA定量试剂盒,测定流程按试剂盒说明书进行,计算水稻种子中OsrHSA的含量。
(五)从水稻种子中纯化OsrHSA的方法
将水稻种子研磨成粉,然后用磷酸盐缓冲液(PBS)(25 mmol/L PB,50 mmol/L NaCl(pH 7.5))在室温下匀浆抽提1h,然后,用醋酸调节pH至5.0,沉淀2h。粗提物离心(12000g,10 min)。大规模纯化时,此步骤可以采用压滤。上清液用pH 5.0进样层析柱Capto-MMC(GE Health)进行纯化,用PBS(25 mmol/L PB,100 mmol/L NaCl(pH 7.0))进行洗脱。Capto-MMC是阳离子交换介质,HSA被吸附在层析介质上,细胞碎片及部分杂质不被吸附,直接流出。收集洗脱液,调节pH为7.5,然后用Q Sepharose Fast Flow(GE Health)进一步纯化,以PBS(25 mmol/L PB,50 mmol/L NaCl(pH 7.5))进行洗脱。Q Sepharose Fast Flow为阴离子交换介质,用于除去抗原类物质、碳水化合物和色素等。含OsrHSA的洗脱液再用Phenyl HP(GE Health)层析纯化,洗脱液为0.45 mol/L(NH4)2SO4。Phenyl HP是疏水相互作用介质,用于除去非抗原性的碳水化合物(包括戊糖、己糖、低聚糖等)和部分色素。含OsrHSA的洗脱液再以Pellicon(Millipore)进行脱盐和浓缩。整个分离纯化过程约需48 h。(https://www.xing528.com)
从水稻种子中纯化OsrHSA过程的主要步骤(图6-6)包括研磨、提取、层析分离、脱盐与浓缩、冻干等过程,需3天。
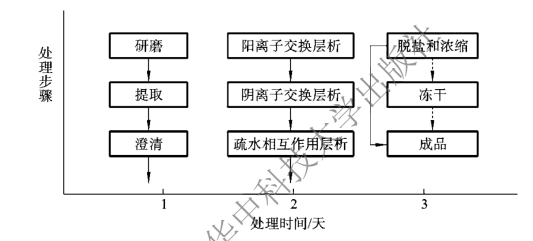
图6-6 从水稻种子中纯化OsrHSA的主要步骤
规模化纯化的收率为55.75%±3.19%;转基因水稻呈棕色,OsrHSA的表达量达到2.75 g/kg。
(六)OsrHSA的纯度分析
(1)电泳分析:采用SDS-PAGE方法。
(2)HPLC分析:采用TSK3000柱对终产品进行分析检测,流动相为PBS(50 mmol/L PB,0.3%NaCl,pH 6.5),流速为1 mL/min。
(七)无菌分装
经过上述分离纯化的OsrHSA纯度可达99.9%以上,可进行制剂。采用的剂型为水溶液,将上述提纯的OsrHSA进行无菌过滤,分装包装,即得到利用水稻进行基因重组生产的HSA。利用这种转基因水稻制备的HSA与人血浆来源的HSA的理化性质、免疫性、体内外有效性均等同,而且,其产量比其他表达体系和同类技术体系均高10~1000倍,成本相当于酵母或细菌成本的2%~10%,相当于动物细胞培养的0.01%~0.05%,并且在一年内即可获得千克级的rHSA,无动物源病毒等污染风险,水稻原料生产能耗为酵母的1/28,二氧化碳和污水零排放。待该技术实现产业化后,可使我国HSA紧缺问题得以解决,还能保障其安全应用,将来,待其产业规模不断扩大后,也有望满足全球对HSA的需求。
附
缩略表

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




