凡参与免疫应答或与免疫应答有关的细胞称为免疫细胞,主要包括淋巴细胞、树突状细胞、单核细胞、巨噬细胞、粒细胞、肥大细胞及它们的前体细胞等。但在免疫应答过程中起核心作用的是淋巴细胞。肿瘤生物免疫治疗是当今继传统的手术、化疗、放疗之后的第四种肿瘤治疗手段,具有安全性高、副作用小和特异性强的优点。作为新型安全的肿瘤治疗方法,肿瘤生物免疫治疗能清除手术后残留的肿瘤细胞,有效缓解患者放化疗后免疫力的降低,提高生活质量、减少复发机会、延长生存时间,肿瘤生物免疫治疗已成为肿瘤临床综合治疗的重要组成部分,是目前国内外研究的热点之一。2013年12月,美国Nature杂志将肿瘤免疫治疗列为年度十大科学突破的首位。免疫细胞治疗是指将免疫细胞经过培养、激活等一系列体外操作后回输到患者体内,用于治疗肿瘤或免疫相关疾病。基于适应性免疫应答理论,免疫细胞治疗可以分为主动免疫细胞治疗和被动免疫细胞治疗两种。主动免疫细胞治疗的代表药物是基于树突状细胞(dendritic cell,DC)荷载抗原的治疗用疫苗,例如美国FDA批准的全球首个用于治疗前列腺癌的疫苗Provenge;被动免疫细胞治疗包括非抗原特异性免疫细胞治疗和抗原特异性免疫细胞治疗。非抗原特异性免疫细胞治疗包括淋巴因子激活的杀伤细胞疗法(lymphokine activated killer,LAK)、细胞因子诱导的杀伤细胞疗法(cytokine induced killer,CIK)和自然杀伤细胞疗法(natural killer)等;抗原特异性免疫细胞治疗包括T细胞受体修饰的T细胞疗法(TCR-T)和嵌合抗原受体T细胞(chimeric antigen receptor T cell,CAR-T)免疫疗法等,其中以CAR-T免疫疗法治疗血液肿瘤的研究最为热门。
(一)CAR-T
1.CAR-T的设计及结构 CAR-T的设计是基于肿瘤特异性识别和T细胞活化的信号转导概念。嵌合抗原受体(chimeric antigen receptor,CAR)是CAR-T的核心部件,赋予T细胞以人类白细胞抗原(human leukocyte antigen,HLA)非依赖的方式识别肿瘤抗原的能力,这使得经过CAR改造的T细胞相较于天然T细胞表面受体TCR能够识别更广泛的目标。CAR的基础设计中包括一个肿瘤相关抗原结合区(通常来源于单克隆抗体抗原结合区域的scFv段),一个胞外铰链区,一个跨膜区和一个胞内信号区。目标抗原的选择对于CAR的特异性、有效性以及基因改造T细胞自身的安全性来讲都是关键的决定性因素。CAR的结构根据研究发展的步骤,已经历了四代(图6-3)。
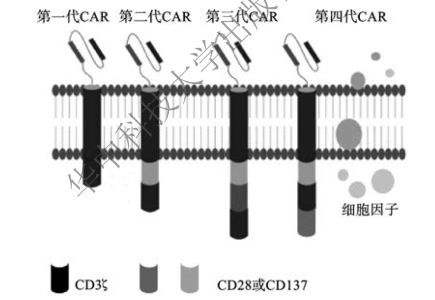
图6-3 四代CAR-T的结构示意图
第一代CAR包括3个组成部分:细胞外可特异性识别并连接肿瘤抗原的结构域、源自抗体的scFv、跨膜结构区和细胞内部提供刺激信号用以活化T细胞的结构域,通常是CD3ζ。第二代CAR在第一代CAR结构基础上连接了一个共刺激信号分子(CD28、CD134或CD137),因此,可使T细胞进一步活化,并获得更长的存活及增殖时间,这弥补了第一代CAR的不足。第三代CAR则是将CD3ζ连接的共刺激信号分子由第二代的一个变为多个,来获得活化更充分的T细胞,这可增强T细胞的增殖能力和裂解肿瘤的能力,并进一步延长T细胞的存活时间。第四代CAR在第三代CAR的基础上引入了细胞因子的表达,因此获得募集免疫细胞的能力。
CAR-T独特的结构和明显的抗癌优势,使其可不通过识别HLA而与肿瘤细胞结合,发挥杀伤作用;这一点与工程化的T细胞受体嵌合型T细胞(T cell receptor-modified T cell,TCR-T)相比优势明显。TCR-T只能识别结合肽的主要组织相容性复合体(major histocompatibility complex,MHC),存在MHC型别的限制性。当肿瘤细胞试图下调MHC的表达来进行免疫逃逸时,并不会影响CAR-T对肿瘤细胞的识别及杀伤作用。CAR-T的另一个优点在于其不仅可结合特定抗原,还可结合碳水化合物、糖蛋白及糖脂。
2.CAR-T的简要生产程序 抗CD19 CAR-T的成功已将CAR的治疗推向了工业化。目前,生产面向市场的抗CD19 CAR-T的有两家公司,均已通过美国FDA审评,分别用于治疗25岁以下复发或难治性B细胞急性淋巴细胞白血病患者和用于治疗三线及三线治疗失败后的成人特定种类的巨B细胞淋巴瘤。
目前,大部分CAR-T的生产程序繁杂且价格昂贵。大体流程都是从患者体内采血,把血样运输到生产的GMP中心,进行T细胞的激活、慢病毒转染以及T细胞的扩增、最终制剂生产和质量控制,最后回到医院回输给患者。CAR-T生产的大体程序(图6-4):①使用单采机器采集患者外周血T细胞。②活化T细胞:活化T细胞通常使用抗CD3和抗CD8的免疫磁珠,也可加入IL-2等细胞因子以增强活化效果。③将通过基因工程合成的CAR转导入T细胞,转导方法可分为病毒转导(腺病毒、慢病毒、逆转录病毒转导)和非病毒转导(电穿孔、基于转座子或基因编辑系统的转导)。④将CAR-T置入含有IL-2等细胞因子的培养基中培养两周。⑤将CAR-T洗涤、浓缩,并进行质检,质检合格后CAR-T方可回输给患者。

图6-4 CAR-T的生产程序
目前我国有二十几家企业已经申报CAR-T的临床试验,几乎每家企业的CAR-T工艺都有或多或少的不同。虽然过去的20年已经形成了大致的工艺框架,但是工艺的细节仍然有很多改进空间。
3.CAR-T的临床应用 抗CD19 CAR-T用于治疗恶性B细胞淋巴瘤。恶性B细胞淋巴瘤可选的传统治疗方法包括以下几种。①抗CD20单抗:该方法可延长患者的生存时间,但不能治愈。②同种异体造血干细胞移植:虽然其是治愈性的治疗方法,但发生致死性不良反应的风险很高,主要为移植物抗宿主病(graft-versus-host disease,GVHD)。GVHD也是患者发生非复发性死亡的重要原因。因此,CAR-T免疫疗法是一种更安全的选择。虽然抗CD19 CAR-T治疗也存在一定的不良反应,如可导致B细胞缺乏,但患者通常可耐受,因此,抗CD19 CAR-T对恶性B细胞淋巴瘤的治疗是成功的。为评估CAR-T免疫疗法在临床中的作用,已经开展了许多临床试验来证明其安全性和有效性。
虽然CAR-T免疫疗法在恶性B细胞淋巴瘤的临床试验中取得了成功,但其在实体瘤中的应用却遇到了一些困难:①目前缺乏特异性靶向实体瘤的抗原,导致CAR-T脱靶;②实体瘤局部的肿瘤微环境有抑制免疫系统的潜能,免疫细胞的活化及作用发挥会受到免疫负性调节因子如免疫卡控点细胞毒T细胞相关抗原4(cytotoxic T lymphocyte-associated antigen 4,CTLA-4)及PD-1的抑制;③CAR-T对实体瘤的浸润深度受疾病状态及肿瘤负荷的影响。部分早期临床试验旨在验证CAR-T治疗实体瘤的安全性及有效性。在这些研究中,细胞的回输方式并不局限于静脉回输,还包括瘤内注射和动脉给药。目前,实体瘤CAR-T的研究难点在于细胞靶点的选定。因此,实体瘤的CAR-T治疗临床试验较少,其中,胃癌靶点主要包括表皮生长因子受体(EGFR)、人表皮生长因子受体2(HER2)、上皮细胞黏附分子(EpCAM)及癌胚抗原(CEA)(肝样腺癌肝转移)。肝癌的靶点主要包括EGFR、磷脂酰肌醇蛋白聚糖3(GPC3)、CEA、EpCAM。(https://www.xing528.com)
4.CAR-T免疫疗法的不良反应 尽管CAR-T免疫疗法在肿瘤免疫治疗领域展示了巨大的效用,但不能忽视其在治疗过程中严重的不良反应。
(1)脱靶效应:效应细胞作用于肿瘤细胞以外的正常细胞而产生的不良反应。CAR-T产生脱靶效应的原因在于CAR能结合的抗原并非肿瘤细胞特有,而在正常组织中也有表达。如CD19不仅表达于恶性B细胞的表面,也表达于正常B细胞表面。因此,使用抗CD19 CAR-T免疫疗法时,患者很可能发生B细胞缺乏症,并继发感染。
(2)细胞因子风暴:细胞因子风暴是当大量活化T细胞回输入患者的循环系统时,体液中多种细胞因子迅速大量产生的现象,是CAR-T的致死性不良反应之一。其症状表现为高热、低血压、关节/肌肉疼痛、呼吸困难、凝血障碍甚至器官衰竭等。
(3)肿瘤裂解综合征:肿瘤裂解综合征与细胞因子风暴具有相似的症状。通常发生于肿瘤负荷较高的患者中,主要症状包括乏力、发热、僵硬、大汗、厌食、恶心、腹泻等。
(4)其他:除上述3种较常见的不良反应外,CAR-T免疫疗法的不良反应还包括脑水肿和神经毒性等。神经毒性症状包括谵妄、语言障碍、运动障碍、缄默症及癫痫,是另一种发生率较高的不良反应。神经毒性通常出现于抗CD19 CAR-T免疫疗法中,可能是因为抗CD19抗体可穿过血脑屏障。
5.CAR-T免疫疗法的安全性 CAR-T免疫疗法发展至今,虽然疗效显著,但也出现了很多治疗相关的不良反应。因此,如何改造CAR-T的设计,使其在增加效应的同时减少不良反应成为新的研究热点。
(1)肿瘤靶点的优化:①使用新抗原(neoantigen)作为CAR-T靶点。新抗原是突变蛋白产生的抗原和致瘤病毒整合进基因组产生的抗原,是肿瘤特异性抗原,在正常组织中不表达,是安全的CAR-T靶点。目前,研究较多的突变基因包括EGFR和KRAS,其编码的蛋白分别为ErbB受体家族成员和KRAS蛋白。②使用癌睾抗原作为CAR-T的靶点,癌睾抗原是一类能在多种肿瘤组织中表达,但在睾丸、胎盘及胎儿卵巢以外的正常组织几乎不表达的抗原,是较为安全的肿瘤抗原。
(2)开关CAR-T:CAR-T过度活跃可对患者机体造成严重的毒性。2016年,Wu等设想用小分子滴定法来正向调控T细胞活性,且CAR-T的应答时间可通过添加或去除小分子而被可逆地控制。该团队初步设计了分裂受体,即抗原、抗体结合需要不同多肽的异源二聚化来组装功能性受体复合物,为小分子的控制提供了可能。
(二)DC
DC是一种高效杀伤活性的异质性细胞群,其在外周血淋巴细胞中的比例为1%~5%,不具有吞噬能力,但能摄取、加工和呈递抗原,刺激体内的初始型T细胞活化,启动机体免疫应答,因而是一种抗原呈递细胞。人体中还有其他的抗原呈递细胞,但DC的抗原呈递能力最强。DC是由美国学者Steinman于1973年首次在小鼠脾组织中发现的,其因在成熟时伸出许多树突状或伪足状突起而得名。早期对其来源、分化、发育、成熟等缺乏了解,只能从不同的组织中分离DC,这样获得的细胞数量极少,故极大地限制了对其功能特点的研究。直到1972年,Steinman建立了应用GM-CSF从小鼠骨髓中大规模培养制备DC的方法,之后又建立并完善了多种培养扩增DC的方法,对DC的研究才得以深入。20世纪末美国率先在人体开展DC免疫治疗肿瘤的试验,结果令人鼓舞。随后DC成了肿瘤生物治疗的明星,也成了全世界与癌症奋斗的科学家们研究的热点。进入21世纪,国内外科学家发现DC在治疗哮喘等疾病中起到了很重要的作用,并在临床上用于多种肿瘤的生物治疗。DC疗法的过程是取患者自身的单个核细胞在体外活化、增殖后,再转输入患者体内,诱导机体产生特异性或非特异性的免疫应答,在患者体内发挥抗肿瘤和抗病毒的作用。
(三)CIK细胞
CIK细胞是将人外周血单个核细胞在体外模拟人体内环境,用多种细胞因子(如抗CD3单克隆抗体、IL-2和IFN-γ等)共同培养一段时间后获得的一群异质细胞。它是一种新型的免疫活性细胞,增殖能力强,细胞毒作用强,具有一定的免疫特性。由于同时表达CD3和CD56两种膜蛋白分子,又被称为NK细胞样T细胞,兼具T细胞强大的抗肿瘤活性和NK细胞的非MHC限制性杀肿瘤优点。CIK细胞能以不同的机制识别肿瘤细胞,通过直接的细胞质颗粒穿透封闭的肿瘤细胞膜进行胞吐,实现对肿瘤细胞的裂解;通过诱导肿瘤细胞凋亡杀伤肿瘤细胞;CIK细胞还可以分泌IL-2、IL-6、IFN-γ等多种抗肿瘤的细胞因子。CIK细胞回输入机体后可以激活机体免疫系统,提高机体的免疫功能。对于失去手术机会或已复发转移的晚期肿瘤患者,能迅速缓解其临床症状,提高生活质量,延长生存期。大部分运用CIK细胞疗法的患者,尤其是放疗、化疗后的患者,可出现消化道症状减轻或消失、皮肤有光泽、黑斑淡化、静脉曲张消失、脱发停止,甚至头发生长或白发变黑等“年轻化”表现,并出现精神状态或体力明显恢复等现象。
(四)LAK细胞
LAK细胞不是一个独立的淋巴群或亚群,而是NK细胞或T细胞体外培养时在高剂量IL-2等细胞因子诱导下成为能够杀伤NK细胞不敏感肿瘤细胞的杀伤细胞。NK细胞是骨髓来源的大颗粒淋巴细胞,占人外周血淋巴细胞总数的5%~10%。NK细胞能够分泌细胞因子和趋化因子,是机体天然免疫的主要承担者,也是获得性免疫的核心调节细胞,在肿瘤免疫、抗病毒感染及清除非己细胞中发挥重要作用。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




