可用于临床移植治疗的传统体细胞主要有软骨细胞、肝细胞、胰岛细胞、嗅鞘细胞等。这些细胞都已经完成分化,在具体组织器官中起着特定结构作用,并行使一定功能。它们的结构和功能通常比较局限,既不像干细胞那样可以转化为一种或多种其他种类的细胞而具有另外的结构功能作用,也不像免疫细胞那样对机体抵抗疾病具有重要的防御功能,但这类细胞在临床上仍然具有重要的治疗价值。在临床上有过多种体细胞移植的尝试,其中常见的包括软骨细胞移植治疗软骨病变、肝细胞移植治疗肝损害、胰岛细胞移植治疗糖尿病及嗅鞘细胞移植治疗脊髓损伤等。
(一)软骨细胞
关节软骨缺损常见于运动损伤和骨关节炎患者,由外伤、退变、过度使用、磨损或肌肉萎缩等引起,最终将导致膝关节疼痛、畸形、活动障碍等异常表现。由于关节软骨缺乏血管、神经和淋巴组织,关节软骨的再生能力极差,一旦受到损伤或者发生变性,便无法恢复为原来的玻璃软骨状态。随着时间的推移,周围及相对面的软骨也会发生变性。目前的治疗以对乙酰氨基酚、NSAIDs、润滑剂及类固醇激素关节腔注射、软骨保护剂为主,可以帮助患者缓解不适症状,但不能阻止疾病的进展,到疾病终末期进行关节置换手术,用一层金属或生物假体替代软骨,而随之带来的是手术损伤、高昂的费用、术后感觉异常以及植入材料使用寿命的限制等一系列问题。随着软骨组织工程的研究深入,自体软骨细胞移植因取材方便可靠,且移植后无排斥反应,逐渐被广泛应用。
自体软骨细胞移植是基于自体软骨细胞体外扩增后进行回植修复的技术。研究表明,体外培养扩增的软骨细胞能较好地维持其细胞特性,有利于软骨修复,是软骨再生研究中的一个突破性的进展。一项进行了至少10年的随访研究证实,自体软骨细胞移植能使70%的患者获得满意的长期疗效。发展到今天,自体软骨细胞移植术已经进入第三代。
第一代和第二代均为用体外培养的软骨细胞悬液进行移植治疗。1994年Brittberge等首次尝试应用细胞技术修复软骨。其做法是取患者非负重区少量软骨,分离出软骨细胞,然后将其体外扩增培养,再将细胞悬液注射至缺损处以自体骨膜覆盖并严密缝合,此为第一代自体软骨细胞移植术(图6-1)。它存在骨膜增生、供区受损等缺点而导致应用受限。随后,以胶原膜替代骨膜的第二代自体软骨细胞移植术应运而生。组织学检查发现,第二代自体软骨细胞移植术后,再生软骨多为透明软骨。基于该方法的软骨再生已经被商业化,在欧美地区第二代自体软骨细胞移植术的应用已经有数千例,中长期治疗效果良好。但该方法是在悬液状态下进行细胞移植的,所以存在移植后的细胞流失及向损伤部位分布不均等问题。
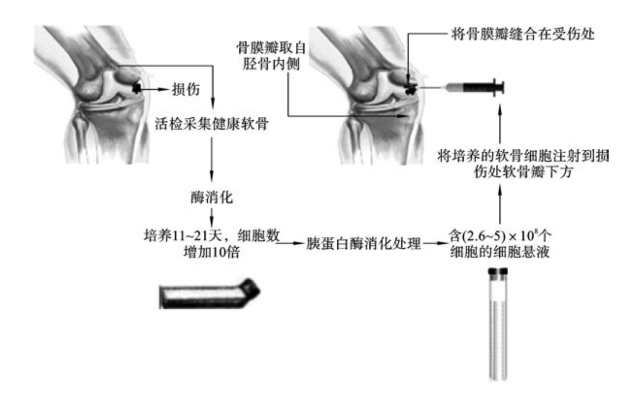
图6-1 第一代自体软骨细胞移植术
为解决前两代软骨细胞悬液移植中存在的缺陷,第三代自体软骨细胞移植术出现了,即基质诱导的自体软骨细胞移植术(matrix-induced autologous chondrocytes implantation,MACI)。MACI首次将软骨细胞种植于过渡性支架上,然后将复合细胞的支架植入缺损处,避免了细胞渗漏,同时支架为细胞提供了临时三维生长空间,有利于软骨细胞表型维持和生长。2016年12月,美国FDA首次正式批准MACI用于临床治疗膝关节软骨损伤,MACI成为细胞组织工程技术在软骨再生领域的一项重大突破。(https://www.xing528.com)
MACI属于利用组织工程技术体外制成关节软骨样组织的移植治疗方法,由Behrens等首次提出,系将提取得到的患者自体健康膝关节软骨组织在体外支架(猪胶原蛋白)进行培养,制成治疗产品,用于治疗有症状的全层软骨损伤成年患者。MACI的操作过程可以简述为,在关节镜下由患者非负重部位(如内侧或外侧髁等)采集200~400 mg软骨组织,利用胰蛋白酶、胶原酶进行酶解后获得软骨细胞,随后在HamF-12培养基中,添加15%自身血清以及1%抗生素进行体外扩增,达到一定数量以后,将软骨细胞种植于猪来源的Ⅰ/Ⅲ型双层胶原膜上,移植时将粗糙面贴近缺损面,然后以生物蛋白胶结合缝合方式进行固定。MACI种植体上装载有大量的软骨细胞,约为每平方厘米50万到100万个。植入MACI的数量取决于患者软骨损伤的范围大小,最终要保证损伤区域完全覆盖。MACI的安全性和有效性已通过一项为期两年的临床试验得以证实,显示其比经典微骨折(治疗软骨损伤的另一项外科治疗方法,在损伤部位向骨髓腔钻孔,利用骨髓干细胞的再生特性修复软骨)治疗产生更长期的临床效益,包括膝关节痛在内的术前症状消失。术后关节镜检查显示,大部分病例形成了透明软骨;相对应的关节面未出现变性等变化;移植部位的硬度,术后早期较正常软骨稍柔软,随后硬度逐渐增加,最终与正常软骨的硬度基本相同。MACI不需要切取骨膜,可避免骨膜相关并发症的发生;手术时间短,切口小,无须缝合,修复率接近100%。当前,该技术已被引进我国。据统计,我国每年有近50万人接受关节镜诊断与治疗,其中近30%的患者患有软骨损伤。MACI是支架、种子细胞和生长因子三大要素的有机结合。从软骨细胞生长所依赖的支架材料来看,还有以透明质酸、硫酸软骨素、纤维蛋白等天然材料为主体的新技术,也获准用于临床。新的支架还在不断研发中,以期获得更适合软骨细胞生长、能更好地解决其去分化现象、更匹配的降解速率和优越的过渡期生物力学性能。水凝胶的出现、温控和光敏材料的应用使得关节镜下注射修复关节软骨成为可能,并可缩短手术时间和降低术后并发症的发生率。尽管这些新型材料均有满意的临床疗效,但目前为止尚未有哪种修复材料可以获得健康软骨的所有特性,且均缺乏大样本、中长期的随访结果。在种子细胞来源方面,胚胎干细胞、骨髓间充质干细胞、脐带干细胞等备受关注,无须切开关节取自体软骨获取软骨细胞进行移植是未来发展方向。
(二)表皮成纤维细胞
2007年10月,美国FDA批准Epicel用于治疗危及生命的严重烧伤。Epicel主要用于30%及以上体表面积严重烧伤的患者,能够为烧伤患者提供永久的皮肤(替代物)。Epicel有2~8个细胞厚度,是由患者自身健康皮肤的表皮组织经培养获得(图6-2(a))。培养过程中应用了经辐射的鼠3T3细胞以促进表皮成纤维细胞的扩增。因此,Epicel被美国FDA视作异源移植系统。此外,培养体系中还有抗生素、牛血清、胰岛素、表皮生长因子、氢化可的松等。
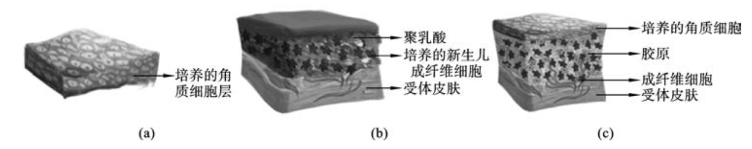
图6-2 表皮成纤维细胞
(a)由患者自身健康皮肤体外培养获得的表皮组织;(b)从新生儿包皮中获取的成纤维细胞体外培养获得的人工真皮;(c)组织工程复合皮肤
Dermagraft是一种人工真皮,是从新生儿包皮中获取的成纤维细胞并接种于生物可吸收的聚乳酸支架上,培养14~17天获得的。由于成纤维细胞在支架上大量增殖并分泌多种基质蛋白,如胶原蛋白、纤维连接蛋白、生长因子等,便形成由成纤维细胞、细胞外基质和可降解生物材料构成的人工真皮Dermagraft(图6-2(b))。其结构更类似于天然真皮,能够减少创面收缩,促进表皮黏附和基底膜分化。Dermagraft既可用于烧伤创面的治疗,又可用于皮肤慢性溃疡创面的治疗,其安全有效性已由糖尿病慢性足部溃疡的随机对照多中心临床研究所证实。
Apligraf是目前研究最成熟的既含有表皮层又含有真皮层的组织工程复合皮肤(图6-2(c))。Apligraf系采用新生儿包皮的成纤维细胞接种于牛胶原凝胶中形成细胞胶原凝胶,然后接种角质形成细胞进行培养制成,Apligraf已获美国FDA批准用于糖尿病性溃疡和静脉性溃疡等小面积创面的修复。对非感染性神经性糖尿病足部溃疡治疗的多中心临床研究表明,采用Apligraf治疗优于采用湿纱布治疗的对照组。应用Apligraf治疗静脉性溃疡比传统方法更为经济有效。此外,Apligraf还可用于治疗大疱性表皮松解症、坏疽性脓皮病、溃疡性结节病等。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




