抗体药物的发展经历了鼠源抗体、人源化抗体和全人源抗体三个阶段(图3-11)。全人源单克隆抗体(human monoclonal antibody,HMAb)技术的发展始于20世纪90年代,主要包括以下几大类:人-人杂交瘤技术、B细胞培养技术(含B细胞永生化技术、非永生化的B细胞体外刺激培养技术等)、高通量抗体库技术和转基因鼠技术等。根据抗原-抗体复合物的晶体结构,借助分子设计技术从头设计全人源抗体是近几年发展起来的新技术。2002年美国FDA批准了第一个全人源抗体药物阿达木单抗,截至2018年底已有28个全人源单克隆抗体药物,其中有8个是利用转基因小鼠技术获得的。
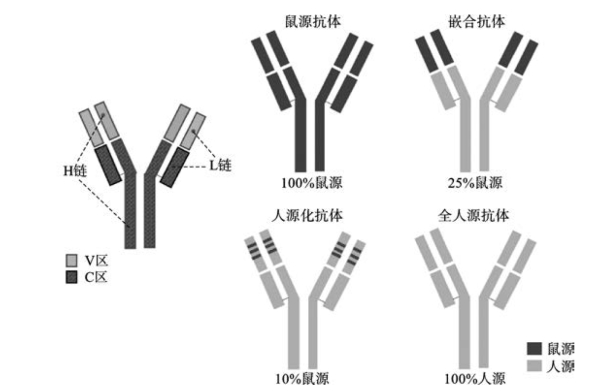
图3-11 治疗性抗体发展历程
(一)人-人杂交瘤技术
B细胞杂交瘤技术是制备单克隆抗体的主要方法,将具有抗体分泌能力的B细胞与具有无限增殖能力的骨髓瘤细胞融合,获得分泌抗体的具有无限增殖能力的杂交瘤细胞株。人单克隆抗体也可以用此原理制备,但有两个主要问题。首先是人骨髓瘤细胞的来源问题。从20世纪70年代起陆续建立了一些可供人-人杂交瘤技术制备用的人骨髓瘤细胞系和能产生人Ig的淋巴母细胞株,例如,骨髓瘤细胞系SKO-007、TM-H2、DHMC等,淋巴母细胞系LICRLon-HMy2、GM1500等,但这些细胞系存在融合率低、杂交瘤细胞不稳定等问题。虽然近年来有新的人骨髓瘤细胞系建成,但仍然不能完全克服上述问题。其次是人B细胞的来源和免疫问题。要获得针对某种特定抗原的抗体,必须先要有足够数量的分泌这种抗体的B细胞;特定抗原致敏的人B细胞在人单克隆抗体制备中至关重要。但除了接种疫苗或被某些病原微生物感染的人群,一般不能像动物一样对人体进行这种抗原致敏。因此,杂交制备的人单克隆抗体通常特异性和亲和力均不高。分离外周血、扁桃体和病灶部位浸润的淋巴细胞中的B细胞,用各种细胞因子和抗原在体外刺激,可在一定程度上解决致敏B细胞的来源问题。此外,人单克隆抗体的研制还需要解决生产问题。已建株的细胞可在体外培养,从培养液中收集抗体;也可以接种入动物体内,由动物体液收集抗体。通常,后一种方法较为简便,抗体产量较高。但人-人杂交瘤细胞接种于动物体内会遭到种间排斥,因此必须进行无血清体外培养等研究。
(二)B细胞培养技术
近年来,越来越多的全人源单克隆抗体采用B细胞培养技术筛选获得,这类技术又可以分为两大类:B细胞永生化技术及非永生化的B细胞体外刺激培养技术。
1.B细胞永生化技术 体外培养永生化技术以Epstein-Barr病毒(EBV)永生化技术为主。EBV在体外能使人记忆B细胞永生化并持续分泌抗体。借助流式细胞仪、磁珠分离技术等,在EBV感染之前,从外周血淋巴细胞中筛选出抗原特异性的B细胞,然后感染病毒建立各种分泌人单克隆抗体的细胞系。该方法的进一步改进是在EBV感染B细胞之前利用非甲基化的CpG二寡核苷酸刺激外周血淋巴细胞以提高EBV的转化效率。基本流程:首先分离有潜在抗体的志愿者外周血单核细胞PBMCs,利用CD22磁珠将PBMCs中的非B细胞部分及浆细胞部分分离去除,然后通过流式细胞仪,将IgM、IgD、IgA类型的B细胞分离去除,得到分泌IgG的记忆B细胞。再利用EBV转化的绒猴白细胞B95-8培养上清液为条件培养基以及CpG2006为免疫增强剂,同时以辐照过的同源异体单核白细胞作为饲养细胞,铺板培养这些B细胞,检测细胞上清液,筛选抗原特异性的B细胞克隆,并进一步克隆化培养,最后获得阳性的单克隆B细胞群。克隆获得其中的抗体基因可在哺乳动物细胞表达系统大量表达有关抗体。
该方法遇到的主要问题仍然是致敏B细胞的来源。此外,永生化的淋巴母细胞系在体外培养时间过长时,抗体活性会丧失。
2.非永生化的B细胞体外刺激培养技术 非永生化的B细胞体外刺激培养技术的整个技术周期相对较短,比永生化技术至少减少半个月的筛选时间。通常需要选择特定的供血志愿者,一般是疫苗免疫、天然免疫康复、病后康复的患者。首先分选特定供血者的外周血单核细胞,利用流式细胞仪分选单核细胞中的CD19阳性、IgM阴性、IgA阴性细胞,再采用有限稀释法,以IL-2及IL-21作为刺激细胞因子,以辐照过的3T3-CD40L细胞作为提供CD40L的饲养细胞,进行铺板培养,检测细胞上清液的特异性,阳性培养孔进一步进行RT-PCR操作,克隆抗体V区轻链及重链基因,再进行重组表达并验证其抗体的性质。
(三)高通量抗体库技术
1.噬菌体抗体库技术 20世纪90年代,噬菌体抗体库技术的出现为抗体人源化和全人源抗体的制备开辟了新途径。该技术在体外模拟抗体的体内成熟过程,从B细胞中扩增全套抗体的轻链和重链基因,克隆到特定载体上,使抗体展示于噬菌体表面,构成噬菌体抗体库(phage antibody library),库容一般在107左右;用抗原筛选出表达相应抗体的噬菌体,经扩增、测序可获得特异性抗体基因(图3-12)。如果B细胞来源于人外周血,则可获得人源抗体。噬菌体表面展示技术的优点是可以直接得到全人源抗体,不需要经过免疫系统和免疫步骤,避免了鼠源抗体的人源化改造过程,并且可以在体外对抗体的亲和力和特异性进行改造。用该方法获得的第一个上市抗体是阿达木单抗。
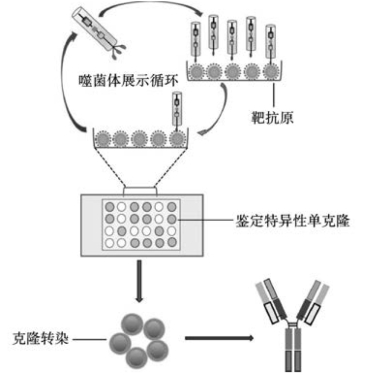
图3-12 噬菌体抗体库技术示意图
抗体库的质量(多样性和亲和力)与抗体库的库容成正比。为了获得高亲和力的抗体,往往需要大容量抗体库。因此,人们在噬菌体抗体库的基础上,引入Cre-LoxP体内重组系统。借助该系统,一个细菌同时被多个噬菌体感染后发生重组,可以得到库容大于1011的抗体库。除了展示在噬菌体表面,抗体基因也可以展示在酵母、细菌表面和核糖体上。

知识链接3-1
2.合成抗体库 抗体库的抗体基因,既可来源于人或动物的外周血淋巴细胞、骨髓、脾细胞等生物样本,也可以通过基因合成获得(即合成抗体库);同时,一个抗体库中可以既有生物来源的抗体基因,又含有合成的抗体基因(即半合成抗体库)。根据人抗体基因的保守性,对人类抗体胚系基因及所有重排序列进行分组,其中95%以上的序列可归为14个亚组:7个重链VH亚组(VH1A、VH1B、VH2、VH3、VH4、VH5、VH6),4个Vκ亚组(Vκ1、Vκ2、Vκ3、Vκ4)和3个Vλ亚组(Vλ1、Vλ2、Vλ3),亚组中的每个成员之间都有高度的同源性。因此,可以设计合成14个亚组各自通用的基因,作为构建组合抗体库(combinatorial antibody library)的主干基因,由此组合而成的抗体库称合成抗体库。与生物来源的抗体库相比,合成抗体库的优点在于库的内容、位点变异性及库的整体多样性均可操作和控制。在合成过程中可以在各种元件两侧引入合适的限制性内切酶位点,便于进行基因操作,例如,将轻链、重链的CDR区设计成两侧带有酶切位点的盒式结构,便于替换;也可以引入大肠杆菌偏爱性密码子,使其在大肠杆菌中高效表达;载体和抗体基因的模式设计及模块性操作使得单链抗体(scFv)能够通过简单的克隆步骤,快速切换成不同的小分子抗体形式,如二硫键连接Fv片段、Fabs、免疫毒素或多价结构的抗体等。
3.抗体库的筛选 抗体库都需要经过筛选才能获得需要的特异性抗体。常规筛选抗体库的方法是用一个抗原通过类似亲和层析的方法,从抗体库中将与之结合的抗体“钓”出来,由此衍生出多种抗体库筛选技术。
以噬菌体抗体库筛选为例,最常用的是固相筛选法:将纯化的抗原包被在酶联板或免疫试管等固相介质上,或将其交联制备成亲和层析柱进行筛选。该方法的缺点是有些抗原被固定后构象会发生变化,筛选出的抗体不能识别天然抗原。通过包被另一个针对该靶抗原的抗体,由它结合靶抗原进行间接筛选,可以在一定程度上解决抗原构象改变的问题。另一种是液相筛选法:将抗原标记生物素后,在液相中利用链霉亲和素化的磁珠进行筛选。该方法筛选效率高,但易分离到抗链霉亲和素的抗体。可以先用链霉亲和素化的磁珠除去抗体库中抗链霉亲和素的抗体,然后用抗原筛选。液相筛选法克服了抗原构象改变的问题,但需注意抗原经生物素标记后,某些抗原表位可能会改变。近年来也有用完整细胞对抗体库进行直接筛选的方法,这种方法特别适合难以表达和纯化的细胞膜抗原筛选抗体。借助流式细胞仪以及磁珠分选技术,通过不同类型细胞的阴性筛选和阳性筛选,可获得特异性抗体。
特别值得指出的是,利用某些抗体与细胞膜抗原结合形成复合物可被细胞内化的特性,经过洗涤、裂解靶细胞可获得细胞内化型抗体。这些抗体可能适合制备抗体-药物偶联物。体内筛选方法是将抗体库直接静脉注射到动物体内,然后从靶器官或组织中洗脱特异性结合的抗体,这种方法适用于分离组织特异性标志物的抗体。Colony-lift assay筛选技术是将抗原吸附在膜上,与涂布在平板上的抗体库反应,能与抗原结合的抗体留在膜上,加入酶标二抗反应后显色;根据膜显色情况在抗体库平板上找出相应菌落,进行扩增和分析,获得相应抗体基因。该方法可以一次对多个抗原进行筛选。(https://www.xing528.com)
4.抗原表位定向选择 抗原表位定向选择(epitope guided selection)是利用抗体库技术进行鼠源抗体人源化的又一种方法。将鼠源抗体的轻链或重链文库,与人抗体的重链或轻链文库配对构建成“人-鼠杂合抗体库”,筛选与抗原结合的克隆,分离获得人抗体的重链或轻链基因;再将它们与人的轻链或重链文库配对,用抗原筛选,就能得到与抗原结合的特异性人源抗体。
(四)转基因鼠技术
转基因鼠技术制备全人源抗体是目前全人源抗体研究的主流,截至2018年底,已经有28个由转基因小鼠制备而来的全人源抗体被美国FDA批准上市。转基因鼠技术首先是利用同源重组等基因灭活技术敲除鼠内源性IgH基因和Igκ基因,消除内源性基因对后续转入的人Ig基因的竞争。这种转基因鼠平台中转入小鼠的人Ig基因在小鼠的免疫系统中能够进行天然抗体的多样性与克隆选择,如发生于骨髓的抗体基因重排(gene segment rearrangement)、发生于淋巴结生发中心的抗原诱导的体细胞高频突变(somatic hypermutation)等,使通过该平台所得的抗体类型更丰富,具有更高的亲和力、稳定性和可溶性等成药性质。
人类Ig基因结构巨大且组织复杂,包括位于染色体14q32.33的重链H(IgH)基因位点、位于染色体2p11.2的轻链κ(Igκ)基因位点和位于染色体22q11.2的轻链λ(Igλ)基因位点。因此,转基因小鼠用于全人源抗体筛选制备的另一个关键技术是能够将大于100 kb的基因转入小鼠基因组,而基因组克隆和操作技术,包括酵母人工染色体(yeast artificial chromosome,YAC)、细菌人工染色体(bacterial artificial chromosome,BAC)、人类人工染色体(human artificial chromosome,HAC)等技术的发展使克隆、操纵和修饰大片段的DNA成为可能;同时,将大片段DNA导入小鼠基因组的方法也有了相应进展。构建1 Mb以上的转基因结构能够使其携带更多的顺式调控序列而改进Ig基因的功能,携带更多的可变区基因片段从而提供更多可选择的抗体。
基于对小鼠和人免疫反应与免疫球蛋白产生机制的理解,转入小鼠体内的人免疫球蛋白基因必要的构成元素包括IgH基因的VH、DH与JH基因片段,为B细胞发育和初始免疫反应传递信号的重链恒定区Cμ基因,发生二次免疫应答必需的至少一个重链恒定区Cγ基因以及对免疫反应精细调控和更广泛初始免疫反应起重要作用的重链恒定区Cδ基因。对重链基因进行复杂调控的顺式作用元件同样重要,包括但不限于内含子与3'增强子、Cμ与Cγ上游的类型转化区域、VH、DH与JH各自的顺式作用元件。轻链基因复杂程度较低,但同样需要V、J、C基因与相关的顺式作用元件。
就转基因小鼠的制备方法而言,大致有以下3种方法。
(1)微基因重组技术:该技术是将人Ig基因库中间断存在的基因片段连在一起,分别组建成轻链、重链微基因,随后将这些构建的微基因质粒注入小鼠胚胎原核中,从而获得含有人重链和轻链的转基因鼠。用这些转基因鼠与内源性重链和κ链缺失的小鼠杂交,经一系列选育,最终获得双转移基因(人H、κ链)和双链缺失(小鼠H、κ链)的纯合小鼠。以特异性人抗原免疫小鼠后,取其脾细胞或淋巴结淋巴细胞与鼠骨髓瘤细胞融合从而获得分泌特异性人源抗体的杂交瘤细胞。
(2)酵母人工染色体:该法是将未重排的人Ig胚系基因酵母人工染色体(YAC)转入小鼠。具体制备方法有两种:一种是基因微注射法;另一种是原生质融合法,即去除含YAC的酵母细胞壁,使其球状原生质与鼠胚胎干细胞融合,然后将整合有目的基因的融合干细胞导入小鼠囊胚,获得嵌合体小鼠后,再通过转基因鼠间杂交可筛选出产生全人源抗体的小鼠。
(3)转染色体技术:该技术是通过微细胞介导染色体转移(microcell mediate chromosome transfer,MMCT)技术将人14号染色体IgH胚系片段、2号染色体κ轻链片段、22号染色体λ轻链片段,转染到ES细胞(图3-13)。利用该技术可以将人所有Ig基因转入小鼠,但抗体产量较低,原因可能是转入的人染色体在鼠细胞中不稳定,目前解决的方法是与其他技术所获得的转基因小鼠杂交育种。
转基因小鼠制备全人源抗体技术发展至今,最为成熟且应用广泛的两个转基因鼠技术平台为HuMAb-Mouse与XenoMouse技术。
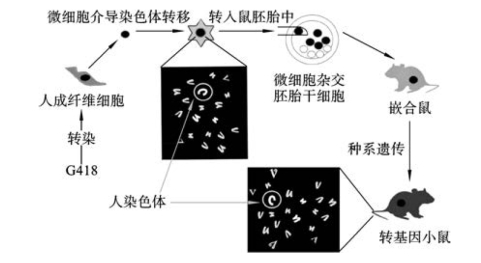
图3-13 染色体转移技术制备转基因小鼠示意图
在HuMAb-Mouse技术中,转入小鼠的人重链基因座由一个80 kb的DNA片段组成,包含4个功能性VH片段、15个D片段、6个J片段以及μ、γ1编码外显子及二者相应的转变区,同时还带有一个Jμ内含子的增强子以及大鼠3'重链增强子。轻链基因座由一个43 kb的DNA片段组成,包含4个功能性Vκ片段、5个J片段、1个Cκ外显子以及内含子及下游增强子元件。外源基因座通过显微注射导入小鼠受精卵中,经同源重组进入小鼠基因组,含有上述外源轻链和重链基因的小鼠胚胎干细胞发育成小鼠后与内源重链和κ轻链基因靶向突变的小鼠一起进行育种,最终双转基因/双突变小鼠能够表达人IgM,并且能够发生抗体类型转换及体细胞突变过程,产生IgGκ。之后为了增加Vκ与VH基因重排的多样性,HuMAb-Mouse通过携带人基因组中额外编码可变区基因片段的YACs或BACs与核心转基因座的共同导入,增加可变区基因片段。
XenoMouse技术使用了可携带更大DNA片段的YAC,因而导入更大片段人Ig基因,Vκ与VH大小分别为800 kb与1020 kb。重链包含34个V区基因、所有的重链D区和J区基因,以及Cγ2、Cμ和Cδ基因,共66个功能基因;轻链包含18个V区基因、所有的5个J区基因、Cκ基因,共32个功能基因。该技术的转基因小鼠XMG2-KL可以产生全人源IgM与IgG2,同时转入替代Cγ2基因的Cγ1基因和Cγ4基因,又分别构建得可以产生全人源IgG1与IgG4的品系小鼠XMG1-KL和XMG4-KL。为了增加产生抗体的多样性,第3个包含全人Igλ基因的YAC被导入XenoMouse,所得品系能够产生中和性IgGλ单抗,亲和力达到皮摩尔级甚至更低。
转基因鼠技术可在小鼠免疫后通过杂交瘤制备全人源单抗用于前期的药物研究,但是更为常见的是通过杂交瘤克隆编码人源单抗可变区的编码序列,与人源恒定区进行表达载体的分子构建,再转入CHO细胞之类的生产细胞进行重组表达,这也是嵌合抗体与人源化抗体制备的标准程序。

知识链接3-2
现阶段美国FDA批准上市的治疗性单抗,主要以噬菌体抗体库技术及转基因鼠技术平台为基础获得。无论是噬菌体展示、酵母展示、核糖体展示、合成抗体等抗体库技术,还是人杂交瘤、转基因鼠或借助分子设计从头设计人源抗体等技术,都会产生多个候选的抗体。这些候选抗体的传统评价指标包括与抗原的结合动力学、细胞功能试验、动物试验等功能活性,但对其进行成药性评估同样很重要,包括哺乳动物细胞表达产率、抗体的理化性质(如等电点、电荷分布、疏水性、热力学稳定性、黏度等)、翻译后修饰(如可变区的糖基化、赖氨酸糖基化等)、化学稳定性(如聚体、断裂、氧化脱氨基、天冬氨酸异构等)、药代动力学(如FcRn结合动力学)等特征的评估,从而可以确定进入规模化生产、人体临床试验开发的抗体药物(图3-14)。

图3-14 抗体药物研发流程示意图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




