抗体融合蛋白(antibody fusion protein)是指利用基因工程技术将抗体片段与其他生物活性蛋白质融合所得的产物。抗体融合蛋白的构建形式主要有两种,即分别利用抗体的可变区片段和恒定区片段的特点,使抗体融合蛋白具有抗体的某项特性,从而形成两大类抗体融合蛋白。一类是将抗体的可变区片段(Fv段)与其他生物活性蛋白融合,利用抗体Fv段特异性识别的特点将特定的生物活性物质导向靶部位(图3-9(a));另一类是含抗体Fc段的融合蛋白,利用Fc段的ADCC效应和CDC效应或延长体内半衰期(图3-9(b))的特点。
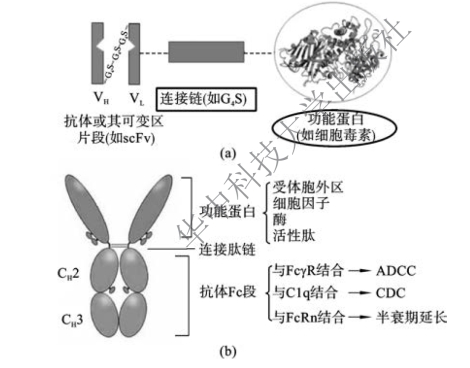
图3-9 抗体融合蛋白结构示意图
(一)Fv抗体融合蛋白
免疫导向治疗尤其是肿瘤治疗是Fv抗体融合蛋白的主要应用领域。如将能够识别肿瘤的抗体scFv或Fab段与假单胞菌外毒素A、肿瘤坏死因子、白介素-2(IL-2)等融合,融合蛋白能将其融合的毒素、细胞因子等导向肿瘤细胞,直接杀伤肿瘤细胞或介导T细胞产生杀伤效应。处于Ⅲ期临床膀胱癌治疗试验的Oportuzumab monatox,是由一种重组人源化抗靶向上皮细胞黏附分子(EpCAM)抗体scFv与假单胞菌外毒素A偶联而成的。如将scFv段与细胞膜蛋白融合可得到嵌合受体,该嵌合受体可赋予特定细胞与抗原结合的能力。如将抗体的可变区基因与T细胞上TCR的α链和β链的恒定区融合,将融合基因导入T细胞,可使T细胞具有该抗体的特异性,对表达相应抗原的靶细胞产生细胞杀伤效应,此即CAR-T免疫疗法的基础。在构建Fv抗体融合蛋白时还可根据需要保留某些恒定区,使其具备一定的抗体生物效应或功能。(https://www.xing528.com)
(二)Fc抗体融合蛋白
将抗体Fc段与其他生物活性蛋白融合而获得的抗体融合蛋白,又称为免疫黏附素(immunoadhesin)。Fc段融合产生的效果:①通过与新生Fc受体(FcRn)或其他类似受体结合,延长该蛋白在血液中的半衰期;②Fc介导的抗体效应功能,包括ADCC效应和CDC效应,即通过该功能蛋白与其配体的相互作用,将Fc段的生物效应引导到特定靶标。例如CD4与Fc段的融合构建,将CD4分子的胞外区部分基因与Fc段基因重组融合后,在真核细胞分泌表达得到CD4-Fc融合蛋白,不仅半衰期较长,可封闭HIV-1包膜糖蛋白gp120与CD4+T细胞的结合,阻断病毒对敏感细胞的感染,并对感染的细胞发挥ADCC效应。另一个免疫黏附素的例子是肿瘤坏死因子(TNF-α)受体和抗体Fc段的融合蛋白。依那西普(Etanercept)是由两个Ⅱ型TNF-α受体p75的胞外段和人IgG1的Fc段结合而成的融合蛋白,与内源性可溶性受体结构相似,可与细胞外液中的可溶性TNF-α以及细胞膜表面的TNF-α高亲和结合,相对分子质量为150000,在人体内的半衰期为(102±30)h,于1998年获美国FDA批准上市,用于治疗类风湿性关节炎。
基于基因工程抗体分子和基因融合原理的抗体融合蛋白多用作免疫导向药物,这类药物可以减少对正常细胞的非特异性杀伤效应,目前已用于杀伤肿瘤细胞、溶解血栓等治疗。例如,将靶向肿瘤细胞的抗体Fab或scFv和假单胞菌外毒素A、TNF、IL-2或β-内酰胺酶等融合,在维持两个部分蛋白各自特性的前提下,融合的毒素、细胞因子等可直接杀伤肿瘤细胞或介导T细胞产生杀伤效应。其他应用如B7-抗体融合蛋白用于T细胞增生的共同刺激,抗CD20抗体和人的β-葡糖醛酸酶融合蛋白用于抗体导向的酶前体药物治疗等。
目前抗体融合蛋白构建的主要问题是抗体片段和生物活性蛋白之间的连接问题。对于连接肽的选择,要求连接肽既应具有足够的柔软性和亲水性,以保证抗体和生物活性蛋白二者的正常折叠,还要求不能轻易断裂或水解,以提高抗体融合蛋白的稳定性;而且连接肽应尽量短并保持中性以降低其免疫原性。普遍采用的连接肽螺旋链或(Gly4 Ser)n线状链仍不能满足各方面的要求,需要通过基因修饰减少其副作用。其他问题如应该增加抗体分子和生物活性蛋白的多样性,提高抗体分子的特异性和亲和力以及生物活性蛋白的专一性作用等,以便其可广泛用于免疫治疗、免疫诊断,特别是用于免疫导向药物的制备。基因工程构建的抗体融合蛋白可在原核生物、单细胞真核生物、哺乳类动物以及植物中得到有效表达,具有很大的应用潜力。但由于高活性的抗体融合蛋白的表达相当困难,产率低,还应通过各种表达途径和表达方法提高其表达产量和生物活性。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




