治疗性抗体的作用机制之一是利用抗体的靶向性,将抗体导向靶部位。抗体-药物偶联物(antibody-drug conjugate,ADC)是以抗体或抗体片段为载体连接放射性核素、药物或毒素构成(图3-8),又称为免疫偶联物(immunoconjugate)。
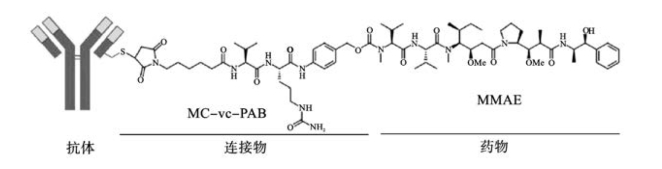
图3-8 抗体-药物偶联物示意图
ADC将单克隆抗体药物的高特异性和小分子细胞毒性药物的高活性相结合,用以提高肿瘤药物的靶向性、减少毒副作用。在理想状态下,该药物前体在系统给药时没有细胞毒性,而当ADC中的抗体与表达肿瘤抗原的靶细胞结合、整个ADC被肿瘤细胞内吞后,小分子细胞毒性药物将以高效活性形式被有效释放,从而完成对肿瘤细胞的杀伤。ADC通常由一个完全人源化的单克隆抗体、一个细胞毒性药物和一个合适的连接物组成。研制安全性高、疗效好的ADC药物依赖于抗体、细胞毒性药物以及连接物的正确选择。
1.靶标与抗体选择 治疗靶标的选择是ADC实现良好临床疗效的重要因素。理想的靶标应该是在肿瘤细胞上特异性表达,或者至少应该是在肿瘤细胞表面表达量相对较高。目前在研的ADC药物靶点几乎涵盖了所有已经确证的药物靶点,除了已上市抗体药物靶点(如HER2、EGFR、CD19、CD22、CD70等)外,诸多新型靶点,如SLC444(AGS-5)、Mesothelin等也成为ADC的作用靶点。许多ADC与靶标结合后,会通过受体介导的内吞作用进入细胞内。内吞作用的速率和程度会影响肿瘤细胞对药物的吸收与释放,不过ADC内吞并不是成功治疗的绝对因素。目前进入临床试验阶段的ADC采用的抗体包括IgG1、IgG2和IgG43种亚型,其中IgG1型应用最为广泛。采用IgG1型抗体的ADC可引发抗体依赖细胞介导的细胞毒作用(ADCC)和补体依赖的细胞毒作用(CDC)。(https://www.xing528.com)
2.连接物与偶联技术 连接物实现抗体与小分子细胞毒性药物的连接,在ADC进入靶细胞前,它能确保偶联药物的完整性。而一旦ADC进入作用靶点,连接物又要确保化学药物的有效释放。目前大多数ADC所采用的连接物可以分为可裂解连接物与不可裂解连接物两类。可裂解连接物在循环系统中相对稳定,在ADC进入细胞后,依靠细胞内微环境(如溶酶体内低pH条件或细胞质基质中的还原性环境)发生降解,从而释放药物,包括腙键连接物和二硫键连接物,每种连接物都有相应不同的肿瘤特异性细胞内条件。采用此类连接物的ADC药物有吉妥单抗(Gemtuzumab ozogamicin)、Inotuzumab ozogamicin等。而不可裂解连接物则需要相应的酶降解连接物或偶联物中的抗体部分来释放药物,如二肽连接物和硫醚连接物。具有不可裂解连接物的ADC必须要求适当的细胞内吞和细胞内降解才能起作用。与可裂解连接物相比,不可裂解连接物在血浆中稳定性更好,其半衰期更长,前者在血浆中的半衰期一般为1~2天,而后者可长达1周。
3.小分子细胞毒性药物 目前小分子细胞毒性药物的种类有放射性核素、化疗药物与毒素,这些物质与抗体连接,分别构成放射免疫偶联物、化学免疫偶联物与免疫毒素。根据其作用靶点主要分为两大类:第一类为微管抑制剂,如奥利斯他汀类(MMAE、MMAF)和美登素类(DM1、DM4),它们通过与微管结合,阻止微管的聚合,阻滞细胞周期继而诱导细胞凋亡;另一类为DNA损伤剂,包括刺孢霉素、Duocarmycin类,它们通过与DNA双螺旋小沟结合,导致DNA的碎裂和细胞死亡。
利用抗体实现细胞毒性药物靶向递送的理念可追溯至20世纪初Ehrlich提出的“魔术子弹”的假说。随着人源化靶向抗体的开发、细胞毒性药物活性的提高、连接技术的成熟、新型连接物稳定性以及裂解效率的增强,ADC的功效开始在动物模型中进行验证,并进入临床研究阶段。吉妥单抗(Mylotarg)早在2000年就已成为首个获得美国FDA批准的ADC,它由一种高活性的抗肿瘤抗生素衍生物和一种抗CD33人源化单克隆抗体IgG4结合而成,用于治疗急性髓系白血病,然而Ⅲ期临床试验发现其具有肝毒性,并且与对照组相比疗效并不显著,于2010年6月申请退市。2011年8月维布妥昔单抗(Brentuximab vedotin)获得美国FDA批准,也是美国FDA批准的首个可用于治疗霍奇金淋巴瘤和系统性间变性大细胞淋巴瘤的药物。维布妥昔单抗的主要成分为抗CD30特异性抗体cAC10、MMAE和连接物(蛋白酶可裂解的共价连接物)。Ado-trastuzumab emtansine(Kadcyla,T-DM1)是由靶向HER2的曲妥珠单抗与微管抑制剂DM1连接的ADC,可用于HER2阳性转移乳腺癌。奥英妥珠单抗(Inotuzumab ozogamicin)是包含一种以CD22为靶点的单克隆抗体的ADC,用于复发或难治性前体B细胞急性淋巴细胞白血病成人患者的治疗。Polatuzumab vedotin由抗CD79b抗体与MMAE偶联,2019年6月获得美国FDA批准,联合苯达莫司汀用于复发性或难治性弥漫性大B细胞淋巴瘤治疗。据MAbs杂志统计,截至2017年5月,约有80个ADC进入各阶段临床试验。
新型ADC仍然存在细胞毒性药物可能提前释放进入全身循环的安全性问题,如何保证ADC在到达靶标细胞后才有效释放细胞毒性药物,是现阶段研究中的一大挑战。同时,ADC的稳定性也依然对连接物及连接技术有很高的要求。如偶联过程不应改变抗体的完整性、与抗原的亲和力、效应功能(若有)以及药物的生物活性。同时,偶联过程应保持单克隆抗体和细胞毒性药物的天然形式,使产品在水溶液中储存或冻干/灭菌过程中保持完整,并保证产品批次的可放大性和产品性质的均一性。目前在临床试验中研究的大多数ADC的偶联过程依赖于药物与抗体中氨基酸残基的连接。赖氨酸残基和半胱氨酸残基是常用的将药物与抗体连接的氨基酸残基,通过基因工程等技术实现位点特异性偶联能够得到更均一的ADC。ADC的产业化制备工艺复杂,包括重组抗体制备、化学药物与抗体的偶联反应和ADC的制剂与质控等环节。但是,ADC在肿瘤治疗领域依然具有明显的优势和强劲的研发势头,具有广阔的发展空间。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




