(一)抗体人源化
嵌合抗体技术通过C区替换将异源抗体改造为约含75%人源抗体成分的抗体,但是V区的框架区(FR)和决定簇互补区(CDR)仍保留了大量的鼠源成分,仍有可能诱导强烈的抗体反应。因此需将鼠源抗体进一步人源化改造,即利用DNA重组技术和蛋白质工程,对抗体基因进行重组,在保留鼠源抗体对抗原有效结合部位的同时,最大限度地降低非结合部位的鼠源性。这种通过重组基因所表达的既有鼠源成分、又有人源成分的抗体称为人源化抗体(图3-7(a))。
人源化抗体的构建思路是借助结构生物学、生物信息学和计算机建模等技术,在嵌合抗体的基础上继续对可变区进行改造,即对可变区(通常是可变区的框架区)进行人源化。相比嵌合抗体,人源化抗体的人源抗体成分更高,一般可以达到90%~95%,因此理论上其免疫原性将大大降低,更好地保证药物的安全性。抗体进一步人源化改造的方法很多,最早的手段是CDR移植,其他常见的人源化改造有表面重塑技术、框架改组技术、链替换技术、去免疫原性技术等。
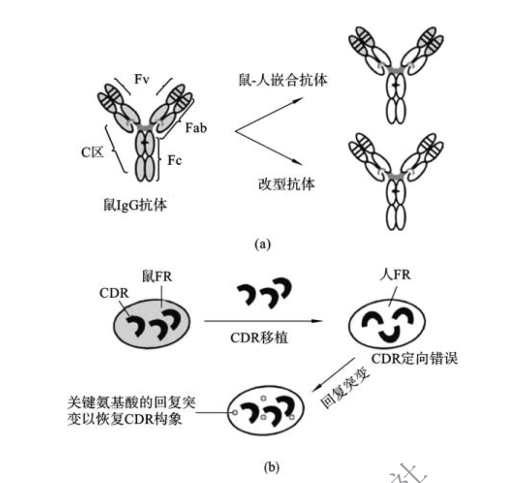
图3-7 改型抗体的构建
1.改型抗体 改型抗体(reshaped antibody)是最早制备的人源化抗体,是将鼠源抗体的恒定区和可变区的框架区全部替换成人源抗体成分,只保留可变区的CDR(图3-7(b))。这种替换相当于在人源抗体的基础上,植入鼠源抗体的CDR,因而改型抗体也被称作CDR移植抗体。改型抗体的人源化程度可高达90%,抗体的半衰期也有所延长。简单的CDR移植往往会明显降低抗体的亲和力,甚至丧失与抗原结合的能力。对此,在CDR移植的同时,可将一些支撑CDR空间构象的鼠源抗体的框架区氨基酸也进行移植,以保持亲本鼠源抗体的亲和力和特异性。另一种策略是通过定向进化等技术使抗体经历体外亲和力成熟的过程,以达到抗体成药的相关要求(见下文后述)。
2.表面重塑抗体 表面重塑抗体(resurfaced antibody)是人们在抗体人源化改造中的又一次重大尝试。其设计思路是在改造框架区时,不用将鼠源抗体的框架区全部换成人源抗体的成分,而只改变其中暴露在表面的起关键作用的氨基酸残基。通过鼠源抗体和人源抗体可变区立体构象叠合比对,寻找合适的人源抗体模板,将鼠源Fv段表面暴露的框架区残基中与人源Fv段不同的位点改为人源的氨基酸,达到鼠源Fv段的表面残基人源化,以期降低免疫原性;由于该方法不影响Fv的整体空间构象,所以获得的抗体仍保留与抗原的结合能力,称之为表面重塑抗体。因其仅将FR区表面的残基进行了替换,因而人源化程度略低于改型抗体。
如果有抗原的晶体结构,则可以采用特异性决定基(specificity determining residues,SDR)移植的方法,该方法首先需要分析待改造抗体的抗原结合位点,或通过抗原-抗体复合物的三维结构确定抗体超变区中与抗原结合的关键氨基酸,然后将这些决定特异性的关键氨基酸移植到相匹配的人源抗体相应位置上。
3.链替换抗体 链替换抗体(chain shuffling antibody)是在定向选择技术的指导下,利用抗体库展示技术,逐步将鼠源抗体的轻链、重链完全替换为人源抗体序列,最终获得与亲本鼠源抗体结合同一表位的全人源抗体。该技术严格意义上属于一种全人源抗体技术,但由于需要原始鼠源抗体作为模板,因此也算一种人源化技术。经典的链替换技术基本过程如下:首先,选择亲本鼠源抗体的一个可变区基因(重链或轻链)与人抗体相应的另一个可变区基因的文库(轻链库或重链库)配对构建成“鼠-人杂合抗体库”,经过筛选获得有结合活性的杂合型抗体;然后,将得到的人(轻链或重链)可变区基因与另一条链(重链或轻链)的人可变区基因文库组合构建成人源抗体库;再经筛选过程,得到与原亲本鼠源抗体特异性识别同一抗原的全人源抗体。应用链替换技术获得成功的如抗TNF-α全人源IgG1抗体阿达木单抗(Adalimumab),于2002年获得美国FDA批准上市,用于治疗慢性关节炎等免疫性疾病。
4.去免疫原性抗体 去免疫原性平台是一个专门的技术平台,包括确定和去除鼠源抗体上能被人T细胞识别的表位,这样的治疗性抗体不再激活T细胞反应以及随后的HAMA反应。类似的去免疫原性策略:①借助抗体空间结构信息判别可能产生的B细胞表位信息,对抗体进行优化;②利用表位预测方法对抗体序列中存在的MHC-Ⅱ抗原表位进行预测,对抗体进行优化;③引入Treg表位,刺激Treg细胞功能,诱导免疫耐受。(https://www.xing528.com)
需要注意的是,所有的生物制药产品都会引起一定的抗药抗体(anti-drug antibody,ADA)反应,即便进一步人源化的抗体或全人源抗体也不例外。如第一个全人源抗体——阿达木单抗中存在多个B细胞表位,导致抗药抗体反应,严重影响其活性,在临床使用中出现一定毒副作用。
(二)抗体亲和力成熟
通过各种技术获得的抗体,往往需要进一步提高亲和力、优化效应功能,才能更好地满足临床应用的需求。
抗体已被广泛用于疾病的诊断和治疗,抗体与抗原高亲和力结合对于提高检测灵敏度、延长半衰期、降低药物剂量、增加药物疗效等都是十分重要的。抗体亲和力成熟(antibody affinity maturation)是指在体液免疫中,再次免疫应答所产生抗体的平均亲和力高于初次免疫应答的现象。抗体亲和力成熟是机体正常存在的一种免疫机制。天然B细胞库产生的抗体亲和力一般较低,在抗原多次刺激和选择过程中其亲和力逐步提高,激活后的B细胞的抗体可变区基因发生高频率突变(体细胞突变),只有突变后亲和力升高的B细胞才易被抗原选择,并进一步增殖分化。因此,经过抗原多次刺激,B细胞产生的抗体亲和力越来越高。然而靠体内亲和力成熟往往仍达不到抗体治疗性用途的要求,因此,需要在体外进行抗体亲和力成熟。现在已有很多方法可模拟体内方式,在体外进行抗体亲和力成熟。
1.CDR区突变 它是一种模拟体内体细胞突变的方法,包括定向诱导突变和随机诱导突变。定向诱导突变需要对抗原、抗体相互作用的立体结构有充分了解,否则成功率不高;而随机诱导突变通过引进随机的碱基替换,进而筛选理想的突变体。易错PCR(error-prone PCR)、DNA改组技术等是引入突变的简便方法。Yang等提出采用序贯优化(sequential optimization)或者平行优化(parallel optimization)的方法对不同的CDR分别引入随机诱导突变,基于抗原、抗体结合性能的改变筛选出亲和力提高的突变体,称为CDR步移(CDR walking)。而采用框架改组(framework shuffling)的方法进行抗体人源化改造,主要是将鼠源抗体的6个CDRs以正确的读框融合到人Ig胚系框架中,构建成抗体库,用相应抗原筛库,由于筛选出的抗体框架来源于相匹配的CDR序列和结构,因此它保留了与抗原的最优结合,这种抗体接近于天然的全人源抗体。
2.链替换 根据抗体可变区随机配对的原理,将抗体的一条链保持不变,替换另一条链,构建轻链重链置换文库,然后用抗原进行筛选,重复进行链替换和亲和力筛选,可产生高亲和力抗体。
3.分子展示(molecular display)技术 分子展示技术包括噬菌体展示技术、细菌展示技术、酵母展示技术、核糖体展示技术和mRNA展示技术等。它们各具特点,都可以用于提高抗体的亲和力,其基本原理是将抗体基因编码的抗体分子展示在细胞或分子表面,通过抗原选择,获得高亲和力抗体。
4.基于计算机辅助设计 目前基于计算机辅助设计提高抗体亲和力的方法主要从构象、能量两个方面考虑。一般为了探讨抗原、抗体相互作用构象的改变,常常利用分子动力学常温构象搜索进行动态分析。通过作用势能面构象搜索,借助距离几何学、分子间氢键理论、溶液可及性表面积以及表观静电势的变化,探讨抗体与抗原作用前后界面构象的特征,从而判别抗原与抗体相互识别的关键位置。进一步利用氨基酸残基的理化性质进行合理的突变,在保证不发生表位漂移的情况下,确保抗原、抗体相互识别的结构匹配性达到最佳。在确定结构匹配最佳的基础上,利用相互作用能、热力学参数的改变定量地进行分析,最终从理论上提出提高抗体亲和力的可能方案用于指导试验。基于计算机辅助设计提高抗体亲和力的方法减少了试验的盲目性,节约了研究成本,提高了效率。然而,设计的成功与否要依赖于抗原、抗体相互作用的动态模式、界面构象特征的合理判定。因此,在抗原或抗原、抗体复合物晶体结构已知的情况下成功率较高。
基因工程抗体亲和力成熟的过程是一个体外分子进化、多样化的选择和扩增的过程。根据对抗体亲和力成熟的认知,有效引入体细胞高频突变,该策略是亲和力成熟的核心,而基于不同原理的突变策略的组合应用,可能对基因工程抗体的亲和力成熟有协同增强的作用。需要注意,抗体多样性的实现还与突变抗体库的库容紧密联系,增大抗体库的库容更易于筛选到高亲和力抗体。此外,高效的筛选方法对于获得高亲和力抗体也有至关重要的作用。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




