抗体(antibody,Ab)是指机体免疫细胞被抗原激活后,由分化成熟的终末B淋巴细胞(简称B细胞)分泌的一类能与刺激其产生的抗原特异性结合的免疫球蛋白。免疫球蛋白(immunoglobulin,Ig)指具有抗体活性或化学结构与抗体相似的球蛋白,可分为分泌型和膜型,前者主要存在于血液及组织液中,具有抗体的各种功能,后者构成B细胞膜上的抗原受体。抗原(antigen,Ag)是指能够刺激机体产生(特异性)免疫应答,并能与免疫应答产物——抗体和致敏淋巴细胞在体外结合,发生免疫效应(特异性反应)的物质。抗原分子中决定抗原特异性的特殊化学基团称为抗原表位(epitope)或抗原决定簇(antigenic determinant)。
(一)抗体的基本结构
Ig单体是由4条肽链通过链间二硫键连接组成的异源二聚体蛋白,结构上呈“Y”字形(图3-1),是Ig分子的基本单位。
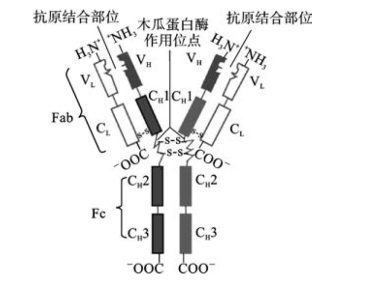
图3-1 免疫球蛋白的基本结构示意图
1.重链和轻链 任何一类天然Ig分子均含4条异源性多肽链,其中相对分子质量较大的一对肽链称为重链(heavy chain,H链),相对分子质量较小的一对肽链称为轻链(light chain,L链)。组成同一Ig单体的4条肽链两端游离的氨基和羧基的方向是一致的,分别命名为氨基端(N端)和羧基端(C端)。同一天然Ig分子中的两条重链和两条轻链的氨基酸组成完全相同。
(1)重链:Ig的每条重链相对分子质量为50000~75000,由450~550个氨基酸残基组成。在重链上结合有不同量的糖基,故Ig属于糖蛋白。各类Ig重链恒定区的氨基酸的组成和排列顺序不尽相同,因而其免疫原性也存在差异。组成Ig的重链有μ、γ、α、δ和e5种,由它们参与组成的相应的Ig分别为IgM、IgG、IgA、IgD和IgE。同一类Ig又可根据铰链区氨基酸组成、重链间二硫键的数目和位置的不同,分为不同的亚类。如人IgG可分为IgG1~IgG4共4个亚类,IgA可分为IgA1和IgA2两个亚类,目前尚未发现IgM、IgD和IgE有亚类。
(2)轻链:Ig的每条轻链相对分子质量约为25000,由214个氨基酸残基组成,由二硫键与重链N端共价结合。轻链有κ链和λ链两种,据此可将Ig分为κ型和λ型。一个天然Ig分子上两条轻链的型别总是相同的。
2.可变区与恒定区 通过研究不同Ig重链和轻链的氨基酸序列发现,靠近N端的约110个氨基酸序列变化很大,其他部分序列则相对恒定。重链和轻链中靠近N端氨基酸序列变化较大的区域称为可变区(variable region,V区),分别约占重链和轻链的1/4和1/2;而靠近C端氨基酸序列相对恒定的区域称为恒定区(constant region,C区),分别约占重链和轻链的3/4和1/2。
(1)可变区:重链和轻链的V区分别称为VH与VL。在V区内,某些区域的氨基酸序列比V区内其他区域的变化程度更高,称为超变区(hypervariable region,HVR)。如重链的第30~35位、第50~63位、第95~102位和轻链的第24~34位、第50~60位、第89~97位。重链和轻链的3个超变区各形成3个环状结构,分别用HVR1、HVR2和HVR3表示,一般HVR3变化程度最高。VH与VL的3个超变区共同形成1个稳定的抗原接触面,与特异性抗原决定簇互补,是特异性抗原与Ig结合的部位(antigen binding site),故超变区又称决定簇互补区(complementarity-determining region,CDR),可用CDR1、CDR2和CDR3表示(图3-2)。不同抗体的CDR序列不同,决定了抗体的特异性。从Ig的抗原性考虑,其独特型决定簇(idiotypic determinant),即该Ig分子所具有的独特遗传标记结构,主要在该区域。可变区中的HVR之外区域的氨基酸组成与序列变化相对较少,称为骨架区(framework region,FR)。
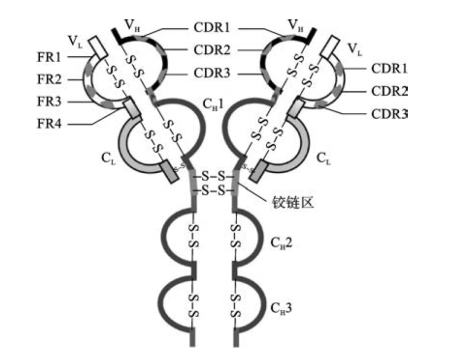
图3-2 免疫球蛋白的决定簇互补区和骨架区
(2)恒定区:靠近Ig分子多肽链的C端的轻链的1/2和重链的3/4区域氨基酸的数目、种类、序列及含糖量都比较稳定,称为恒定区(constant region,C区)。重链和轻链的C区分别称为CH与CL。不同型Ig的CL长度基本一致,但不同型Ig的CH长度不一,有的包括CH 1、CH2和CH3,有的则更长,包括CH1、CH2、CH3和CH4。同一种属的个体所产生的针对不同抗原的同一类别Ig,其C区氨基酸序列比较恒定,其免疫原性相同,但V区各异。例如,针对不同抗原的人IgG抗体,其V区不同,只能与相应的抗原发生特异性结合,但C区相同,均含γ链,因此人IgG抗体(第二抗体)均能与之结合。再如,针对同一抗原的人IgG和IgM抗体,它们的V区相同,因此均能与该抗原特异性地结合,但C区不同,分别含γ链和μ链。
3.铰链区 铰链区(hinge region)位于CH1与CH2之间,富含脯氨酸,具有弹性和伸展性,可改变Ig两个抗原结合部位(Y形臂)之间的距离,有利于Ig与抗原分子表面不同距离的抗原表位结合或使Ig能同时与两个抗原表面分子相应的抗原表位结合;也利于暴露Ig分子上的补体C1q结合位点,为激活补体创造条件。铰链区对木瓜蛋白酶和胃蛋白酶敏感,经酶处理后可产生不同的水解片段。五类Ig或亚类的铰链区不尽相同,例如人IgG1、IgG2、IgG4和IgA的铰链区较短,IgG3和IgD铰链区较长,而IgM和IgE无铰链区。
4.结构域 Ig的多肽链分子可在链内二硫键作用下折叠成数个球状结构,称为功能区或结构域(domain)。每个结构域约由110个序列相似或高度同源的氨基酸组成,每个结构域一般具有其独特的功能。轻链有VL和CL两个结构域,人IgG、IgA、IgD的重链有VH、CH1、CH2和CH3四个结构域,IgM、IgE有5个结构域,多一个CH4结构域。
各结构域的功能如下所述。
(1)VH、VL:Ig分子特异性识别和结合抗原的部位。超变区的氨基酸组成和排列因其相应结合的抗原特异性的不同而不同,故VH、VL氨基酸的种类和排列顺序高度可变,可形成很多能与不同特异性抗原表位结合的抗体。
(2)CL和CH:某些同种异型的遗传标记存在于该区。
(3)IgG的CH2和IgM的CH3:有补体C1q的结合位点,与补体经典途径的激活有关。IgG的CH2与IgG通过胎盘屏障有关。
(4)CH3或CH4:可与多种细胞表面相应的Fc(fragment crystallizable)受体结合,产生不同的免疫效应。人IgG1、IgG2、IgG4亚类CH3与葡萄球菌A蛋白(staphylococcal protein A)结合,可用于纯化抗体和免疫诊断等。
5.Ig的其他成分 Ig轻链和重链除上述基本结构外,某些类别的Ig还含有其他辅助成分,分别是J链和分泌片。
(1)J链(joining chain)是由浆细胞合成的一条富含半胱氨酸的多肽链,主要功能是将单体Ig连接为多聚体(图3-3),并使之稳定。如2个IgA单体由J链相互连接形成二聚体,5个IgM单体二硫键相互连接,并通过二硫键与J链连接形成五聚体。IgG、IgD和IgE无J链,均为单体。
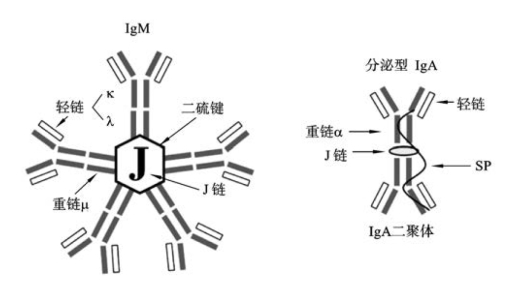
图3-3 IgM与分泌型IgA结构示意图
(2)分泌片(secretory piece,SP)又称分泌成分(secretory component,SC),是由黏膜上皮细胞合成的含糖肽链,以非共价形式与IgA二聚体结合,使其成为分泌型IgA(sIgA)。其功能是保护sIgA免受外分泌液中蛋白水解酶的水解作用,并能介导IgA二聚体的转运,使其分泌至黏膜表面,发挥黏膜保护作用。
6.Ig的水解片段 一定条件下,Ig分子肽链的某些部分易被蛋白酶水解为不同片段。木瓜蛋白酶(papain)和胃蛋白酶(pepsin)是较常用的两种Ig蛋白水解酶。木瓜蛋白酶水解IgG的部位是在铰链区的重链链间二硫键近N端侧,可将Ig裂解为2个完全相同的抗原结合片段(fragment of antigen binding,Fab)和1个可结晶片段(fragment crystallizable,Fc)。而胃蛋白酶作用于铰链区的重链链间二硫键近C端侧,水解Ig后可产生一个由2个Fab及铰链区组成的双价大片段F(ab')2和一些小片段pFc'。
(二)抗体的基因结构
1.Ig基因的基本结构 编码Ig的重链以及轻链的κ链和λ链的基因库分别位于不同的染色体上,如人的重链基因库位于第14号染色体,而κ链和λ链基因库分别在第2号和第22号染色体上。每一基因库均由数目不等的一组基因组成。其中编码V区肽链的基因片段称V基因(variable gene),编码C区肽链的基因片段称为C基因(constant gene),在V基因和C基因之间还有J基因(joining gene);在重链基因库中,还有若干多样性基因(diversity gene)片段,称为D基因。编码每种链的基因由不同的基因片段组成,其中重链包含V、D、J和C基因片段,而轻链没有D基因片段。每种基因片段又包含一系列不同的编码基因片段。以人Ig的重链为例,重链基因库中编码蛋白的基因片段包括至少100个V基因、9个C基因、6个J基因和27个D基因片段。
2.抗体基因的重排与表达 编码抗体多肽链的上述基因片段之间被插入序列所分隔,不能作为独立的单位表达,需经基因重排后才具表达功能。Ig的可变区由V(D)J基因片段编码,恒定区由C基因片段编码。基因重排就是指在基因库中选择某些基因片段重新进行组合以得到完整的功能性的Ig编码基因。这种基因重排是骨髓始祖B细胞经前体细胞向成熟B细胞分化的过程中发生的。重链基因重排的顺序先为D-J相连,再是V-DJ相连,然后与C基因片段重排形成编码Ig重链的完整基因。在重链基因重排后,轻链可变区基因片段随之发生重排,形成V-J连接。轻链中κ链基因先发生重排,如果κ链基因重排无效,随即发生λ基因的重排。成熟B细胞两条同源染色体中只有一条染色体Ig的基因得到表达,称为等位基因排除现象(allelic exclusion)。在轻链则不仅等位基因中只有一个表达,κ链和λ链也只有一个得到表达。这现象保证了一个B细胞膜表面所表达的10多万个Ig分子及其后所分泌的Ig分子都具有相同的特异性。
(三)抗体的亲和力与结合力
抗体的亲和力(affinity)是指抗体的结合部位与其相应抗原表位相结合的紧密程度,亲和力越强,则结合越牢固,是用于评价抗体性质重要的指标之一。
抗原、抗体的结合反应通常处于动态平衡状态。对于一对一的结合反应,可以表示为
Ab+Ag⇌Ab-Ag
上式表示的是一种平衡与可逆的状态。当条件改变时,平衡即发生破坏并导致新的平衡产生。例如,降低体系中抗原或抗体的浓度,就破坏了原有的平衡,并使一部分已形成的抗原-抗体复合物解离,即Ab-Ag的浓度降低,生成一些新的游离的抗原或抗体,直至达到新的平衡状态。平衡状态下,抗原、抗体、抗原-抗体复合物三者之间的浓度关系可以表示为
Ka=[Ab-Ag]/([Ab]·[Ag])
Kd=[Ab]·[Ag]/[Ab-Ag]
其中[Ab]、[Ag]和[Ab-Ag]分别表示抗体、抗原以及它们结合生成的抗原-抗体复合物的浓度,其单位为mol/L;Ka表示抗原、抗体形成复合物的结合常数,以浓度的倒数为单位,Kd表示抗原-抗体复合物解离常数,其单位为浓度的单位。(https://www.xing528.com)
一般既可以用结合常数也可以用解离常数来表征抗体亲和力的大小。如使用结合常数Ka表示亲和力,则其值越高,表示亲和力越强,抗原、抗体结合的牢固度越高。对于不同的抗体,结合常数Ka有一个很大的范围,可为105~1012(mol/L)-1或更小。以解离常数表征亲和力时,则是Kd值越低表示亲和力越强。解离常数在形式上与表示酶和底物结合的米氏常数相似。
上述表征亲和力的方法,是一种表征平衡状态的方法,只表示平衡时的状态而不涉及它们是如何达到平衡的中间过程与速度,亦即它难以表征抗原、抗体结合的动态过程。但实际上,抗原、抗体的结合以及抗原-抗体复合物的解离,都需要一定的时间。结合的快与慢,也是结合难易的表现。因此,需要有一个表征动态过程的方法,即动力学的方法。
从动力学的角度来看抗原、抗体反应,其结合作用的快慢,可以用单位时间内抗原、抗体或它们相互作用所生成的复合物的浓度的变化来表征。例如,对于1分子抗原与1分子抗体作用生成1分子抗原-抗体复合物的反应,即
Kd=([Ab]总-[Ab-Ag])·([Ag]总-[Ab-Ag])/[Ab-Ag]
此结合反应的反应速率γ为在单位时间内反应物浓度的降低或产物浓度的增加,单位是mol/(L·s)。
抗原、抗体的结合是一个可逆反应,根据动力学分析,在其正向反应中,正向反应的速率为γ正,γ正=κass[Ab][Ag]。式中κass称为正向反应的速率常数,即动力学结合常数,其意义为反应物浓度为1 mol/L时的反应速率。
此时,逆向反应也在同时进行,其反应速率为γ反,γ反=κdiss[Ab-Ag]。而式中的κdiss则称为逆反应的速率常数,又表示为动力学解离常数。随着结合反应的进行,[Ag]、[Ab],即抗原和抗体的浓度逐渐下降,因而γ正降低、反应减慢。但同时[Ab-Ag],即抗原-抗体复合物的浓度逐渐上升,亦即γ反逐渐升高,逆反应加快。这样,必然在某一时间点γ正=γ反,反应达到平衡。此时,复合物生成速率与其解离速率相等,γ正=γ反。即
κass[Ab][Ag]=κdiss[Ab-Ag]
整理可得
[Ab]·[Ag]/[Ab-Ag]=κdiss/κass=K
从化学热力学角度可知,这里的常数K恰巧也是前面讨论过的平衡状态下的平衡常数,即抗原-抗体复合物解离常数Kd。但需要注意的是,这里的κass和κdiss与平衡状态下的Ka和Kd不同,前者是一种速率常数,会随反应时间的不同而改变;而后者只表示已达平衡状态时的结合与解离常数,不会随时间而改变。
(四)抗体的生物学功能
抗体与抗原结合后在少数情况下可对机体直接提供保护作用,如中和毒素的毒性或抑制病毒对宿主细胞的感染等。但大多数情况下需要通过效应功能灭活或清除外来抗原以保护机体,这些效应功能是由Fc介导的,可造成靶细胞的杀伤,促进细胞吞噬作用,诱发生物活性物质的释放,引起炎症反应等一系列生物学效应。引起效应功能的机制可分为两类,一类是通过补体激活,另一类是通过抗体分子Fc段与各种细胞膜表面Fc受体相互作用。
1.识别与结合抗原 抗体的可变区可特异性识别和结合抗原,从而发挥中和毒素、阻断病原体入侵等免疫学功能。某些病毒、细菌毒素和昆虫或蛇的毒液会通过结合宿主细胞表面的蛋白进入细胞内从而引发相关疾病。中和抗体能够识别和结合病毒和毒素,物理性地防止其入侵细胞,从而保护宿主细胞。
2.补体激活 抗体与抗原结合后,CH2/CH3功能区内的补体结合位点暴露,从而引起补体经典途径。在人体内,IgM、IgG1、IgG2和IgG3可以通过该途径激活补体。各亚类IgG结合补体的能力为IgG3>IgG1>IgG2>IgG4,实际上IgG4几乎不能激活补体,IgG2激活补体的能力也很弱。补体激活过程通过抗体-抗原复合物与补体成分C1q的结合启动,IgG与抗原形成复合物后,IgG与C1q形成多价结合。其中,抗体与抗原结合后引起的抗体分子立体构象的变化是促进其与C1q结合的一个重要的因素。如,当五聚体IgM与处于同一平面的多价抗原结合时,其Fab端弯向一侧,产生新的C1q结合部位。补体激活后可发挥多种免疫学功能,如细胞裂解、免疫黏附及调理、促进炎症反应、免疫调节等。
3.Fc介导的生物学效应功能 在许多免疫细胞的表面表达有可结合抗体Fc段的受体(Fc receptor,FcR)。FcR是由1条可与Fc结合的多肽链(α链)以及1条或多条涉及信号转导的多肽链(β、γ链)形成的多聚体。FcR根据其所结合的抗体类别的不同分为5种:FcγR(结合IgG)、FceR(结合IgE)、FcαR(结合IgA)、FcμR(结合IgM)及FcδR(结合IgD)。每一种FcR中存在的分子结构不同的受体用罗马数字区分,如FcγRⅠ(CD64)、FcγR Ⅱ(CD22)、FcγRⅢ(CD16)等,有些FcR分子结构相似但由不同的基因编码,以A、B、C……表示,如FcγRⅠA、FcγRⅢB。
抗体通过Fc片段与表面具有相应受体FcR的细胞结合,可发挥调理作用(opsonization)、抗体依赖细胞介导的细胞毒作用以及引发超敏反应等。
(1)调理作用:调理作用是指抗原被调理素包被后,吞噬细胞如单核巨噬细胞和中性粒细胞等对抗原的识别能力增强。抗体就是一种作用强大的调理素,尤其是人的IgG1和IgG3,其与抗原结合后能够介导调理作用,从而增强吞噬细胞的吞噬能力。FcγR,尤其是FcγRⅠ,是介导这类效应功能的主要受体。
(2)抗体依赖细胞介导的细胞毒作用:抗体分子与靶细胞表面抗原结合后,可通过其Fc段与杀伤细胞表面的Fc受体相结合,促进对靶细胞的杀伤作用,称为抗体依赖细胞介导的细胞毒作用(antibody-dependent cell-mediated cytotoxicity,ADCC)。当抗体包被的病原体过大而无法被吞噬细胞内吞的时候,ADCC可以有效消灭病原体。当抗体结合到靶标物(如大的细菌、寄生虫、病毒感染细胞或肿瘤细胞等)后,其Fc段会结合到杀伤细胞的FcR引发脱颗粒。颗粒内水解物质的释放会破坏病原体细胞膜,造成其盐浓度失衡并裂解。NK细胞等也会合成并分泌TNF和IFN-γ以促进病原体的死亡。NK细胞是介导ADCC最重要的细胞,其表面介导受体主要为FcγR Ⅲ,这是一种低亲和力受体,只与细胞表面抗原的IgG结合,不能结合循环中的单体IgG。嗜酸性粒细胞表面可表达FcαR和FceR,分别与包被在寄生虫上的IgA和IgE结合以释放颗粒物质。
(3)超敏反应:IgE可直接与肥大细胞和嗜碱性粒细胞表面的FceR结合,诱导其合成并分泌生物活性物质,引起超敏反应。
(4)免疫调节:B细胞表面的FcγR ⅡB可以介导抗体的反馈抑制。如IgG与抗原形成的复合物通过其抗原部分与B细胞表面的抗原受体(B cell receptor,BCR)结合,并通过IgG Fc与FcγR Ⅱ结合,形成BCR与FcR的交联,进而通过FcγR ⅡB胞内部分酪氨酸的磷酸化引起B细胞的抑制。
(5)Fc受体介导的转运功能:除了上述效应功能外,抗体还可通过一些FcR介导胎盘或上皮细胞的转运作用。人体内的IgG通过与胎盘母体一侧的滋养层细胞上的新生Fc受体(neonatal FcR,FcRn)结合,从而进入胎儿血液中行使免疫保护功能。成年人在多种内皮细胞表面表达与此FcRn类似的Fc受体,这种受体可与血液循环中的IgG结合,进入细胞后可保护IgG在细胞内不被降解,然后将其转运到细胞外回到血液循环中,这种保护性受体成为IgG半衰期较长的重要机制。另外一种与转运相关的Fc受体是黏膜上皮细胞表达的多聚Ig受体(pIgR),它可以与多聚体IgA结合并将其转运到外分泌液中。
(五)抗原识别特异性的产生
能与数量众多的不同抗原发生特异性结合是抗体分子的主要特征,这是抗体分子上抗原结合部位(antigen binding site)和抗原表位(antigen epitope)相互作用的结果。
早在20世纪60年代,人们通过对氨基酸序列的分析就发现轻链和重链可变区内分别存在3~4个超变区,推测它们与抗体、抗原的特异性结合有关,这些超变区又被称作抗原决定簇互补区(CDR)。随后用亲和标记实验鉴定抗原结合部位的氨基酸序列,结果证明亲和标记均发生在CDR或其邻近的氨基酸残基。随着X射线晶体衍射和电镜技术的发展,各种抗体和抗体分子片段(绝大多数为Fab片段)的立体结构数据不断累积,抗体的轻、重链上的抗原结合部位已基本确定。可变区的骨架区形成9个反向平行β折叠,这些β折叠组成两个片层结构,由1个链内二硫键固定;骨架区作为支持CDR的支架,立体构象极为保守。VH和VL紧密地结合在一起,形成一个致密的球状结构,成为Fv段,位于Fv段N端的6个CDR形成CDR表面(CDR surface),与抗原直接接触。CDR表面可以有凹陷和凸起,可以有深袋和裂隙,其形状和特性取决于各CDR的氨基酸组成和数目。CDR表面即抗体上的抗原结合部位,也称互补位(paratope)。抗体和抗原的结合不涉及共价键的形成或断裂,仅涉及非共价性质的作用力,包括疏水键、氢键、范德瓦尔斯力和离子键等。抗体、抗原结合的特异性来源于抗体结合部位与抗原决定簇的结构互补,既包括构象的互补,如凹陷与凸起的互补,也有理化性质的互补,如促进疏水键或离子键的形成等。
在CDR表面,重链的CDR1、CDR3和轻链的CDR3位于中央,而CDR1-L、CDR2-L和CDR2-H3个襻状结构只有一部分靠近中央,一部分则远离中央。根据目前已有的抗体-抗原复合物晶体结构,抗体、抗原结合时的包埋面最多仅占CDR表面的1/3左右,结合部位在CDR表面的中央。对各个CDR在结合抗原时的利用情况分析表明,有些CDR不与抗原相接触,唯有两个CDR3总是参与抗原的结合,说明CDR3在抗体结合抗原时的重要性。CDR3还在轻、重链可变区相互作用形成Fv时有重要作用,VH和VL的接触影响了骨架区-骨架区、骨架区-CDR3、CDR3-CDR3的相互作用,涉及CDR3上的多个氨基酸残基,因此CDR3的变化不仅影响抗体结合部位的结构,也可影响Fv的立体构象,在抗体多样性形成中处于关键地位。
另一方面,对于抗体、抗原结合是否会引起立体构象的改变一直存在锁匙机制(lock and key)和诱导契合机制(induced fit)的争议。近年来更多数据支持诱导契合机制的存在,即抗原与抗体结合可诱发明显的构象改变,包括侧链方向的改变、主链片段的变化、CDR表面构象的改变以及VH、VL相对位置的移动等。诱导契合机制的存在说明参与抗体、抗原结合的氨基酸残基实际更隐蔽、更复杂,预测抗体、抗原结合后的构象也更困难,使得基因工程抗体的设计更为复杂。
(六)抗体的多样性
自然界中存在大量的抗原物质,而机体也会产生数量巨大的不同结构的抗体进行免疫应答以保护机体。由于B细胞表面在抗原暴露之前已经存在免疫球蛋白,而且细胞核内也不可能存在大量不同的抗体基因,也就说明细胞只能利用有限的免疫球蛋白基因通过重组以编码出大量的免疫球蛋白。
B细胞在遇到抗原之前所产生的多样性主要来源于B细胞胚系基因库内大量存在的V、D和J基因片段以及这些片段的组合连接,片段之间连接和轻、重链配对的多样性。而抗原暴露之后,B细胞会经历体细胞高频突变进一步扩大抗体的多样性。抗体多样性实现的途径主要有以下几个方面。
(1)轻、重链可变区V(D)J基因重排:轻、重链的胚系基因包含许多V基因片段、D基因片段(轻链无)、J基因片段,各片段之间由内含子隔开。基因重排过程中各片段的随机组合将产生大量不同的抗体。以人可变区基因为例,V区对应有65个功能性V基因片段,27个D基因片段,6个J基因片段,这样就会产生65×27×6≈11000种VH;κ链上有40个功能性V基因片段,5个J基因片段,这样就有200种不同的Vκ。对λ链而言,约有30个V基因片段和4个J基因片段,组合起来有120种不同的Vλ。
(2)连接多样性:抗体各基因片段的连接往往会伴有核苷酸的插入、缺失和替换,从而产生不同的抗体序列。比较典型的连接多样性有以下3种:①删除。在V(D)J基因重排的最后阶段,两条基因片段在连接酶连接之前通常会被外切酶剪切掉一部分原始的核苷酸序列,导致最终序列不同于胚系基因。②P-核苷酸(P-nucleotide)增添。在V(D)J基因重排过程中,序列末端的连接准确性较差,常伴有核苷酸的丢失或插入。重组酶RAG切断后形成的两个序列片段并未直接相连,其断端各自连接形成发夹结构,再被内切酶随机切开,形成带有回文结构(palindrome)的突出单链DNA末端,通过DNA修补,恢复双链并将断裂处连接起来,从而将此回文序列保留在V区的编码序列中,称为P-核苷酸。③N-核苷酸(N-nucleotide)增添。N-核苷酸的增添几乎只发生在重链DJ基因和VD基因连接处。当DJ基因片段和V基因片段的断端出现平端时,TdT酶可随机添加非胚系基因模板来源的核苷酸到末端上,这些加入的核苷酸称为N-核苷酸。
(3)轻、重链的随机组合:不同的轻链和不同的重链随机组合将产生更大的多样性。VH约有11000种,VL组合起来有320余种,因此,轻、重链间的组合多样性将可达3.5×106种。
(4)体细胞高频突变:当机体对同一抗原进行再次应答时,经历过重排的抗体可变区基因可以高于正常突变率至少1000倍的频率发生点突变,从而产生具有更高亲和力的抗体。体细胞高频突变有以下特点:①出现于已发生基因重排的成熟B细胞;②突变频率特别高;③有突变热点位置,且不局限于CDR;④主要发生于二次免疫应答,但B细胞向浆细胞分化完成后突变即停止发生;⑤T细胞依赖性,只针对T细胞依赖性抗原诱导的免疫应答。
(5)体细胞基因转换:人和鼠以外很多物种(如鸟和兔)依靠初始抗体谱的基因转换产生多样性。许多V区假基因片段会复制进入V基因片段造成DNA序列的改变。
(6)受体编辑:受体编辑是指在一定条件下,轻链可变区在VJ基因重排后可进行二次重排。受体编辑往往发生在带有自身抗原特异性受体的B细胞与自身抗原相互作用的情况下。这一相互作用会促使V基因片段和J基因片段发生二次重排,新产生的VJ基因片段将特异性识别外来抗原,而非自身抗原。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




