重组蛋白药物制备的表达系统(图2-1)主要有原核表达系统与真核表达系统。原核表达系统主要是利用原核细胞(prokaryocyte)表达外源蛋白,如细菌(bacteria)。真核表达系统比较复杂,有真核细胞(eukaryocyte),主要包括酵母细胞(yeast cell)、杆状病毒-昆虫细胞(baculovirus-insect cell)、哺乳动物细胞(mammalian cell)、植物细胞(plant cell)等;还有转基因动、植物生物反应器(transgenic animal or plant bioreactors)。
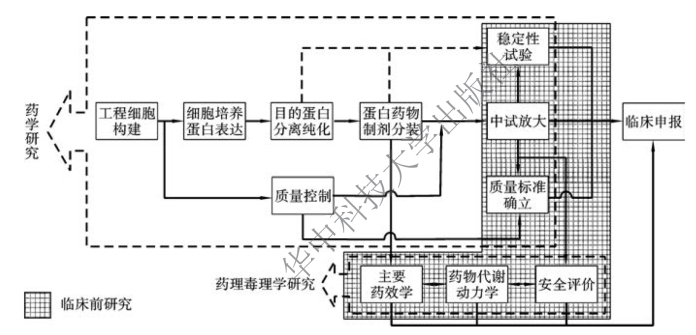
与大部分药物研发过程一样,重组蛋白药物研发主要包括药学研究、药理毒理研究和临床研究三个部分。然而,与传统小分子药物不同,即便已经确立了药物的制备工艺流程,重组蛋白药物的制备过程仍然会在很大程度上影响药物的质量,并直接影响药物的安全性和有效性。因此,从重组蛋白药物的研发流程(图2-2)来分析讨论,有助于更好地了解其制备过程。
重组蛋白药物的药学研究主要包括实验室研究与中试研究两个阶段,其中实验室研究一般主要划分为重组工程细胞(包括动、植物生物反应器)构建、细胞培养与蛋白表达、目的蛋白分离纯化、蛋白药物制剂分装,以及贯穿其间的质量研究与质量控制等模块。中试研究主要包括中试工艺放大、质量标准确立和稳定性试验等模块。药理毒理研究主要包括主要药效学、药物代谢动力学和安全评价等模块。
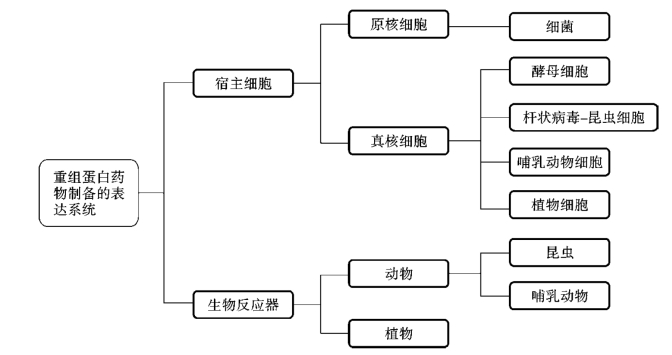
图2-1 重组蛋白药物制备的表达系统
 (https://www.xing528.com)
(https://www.xing528.com)
图2-2 重组蛋白药物的研发流程
当目的蛋白经分离纯化获得一定纯度的蛋白原液,确定初步配方制备出药物制剂后,或在实验室基本确定药物制备流程并生产出来至少一批经初步检验合格的样品(小试)后,应及时开展该目的蛋白及其制剂的稳定性研究,该研究数据可以作为稳定性试验的重要依据和内容;但在申报临床的材料中,必须有中试放大工艺下完成的连续三批试制样品中至少一批样品连续6个月的稳定性数据。质量控制的有关指标、方法和要求,需要参照《人用重组DNA制品质量控制技术指导原则》,与国家指定的质量标准机构合作进行药品质量检定分析方法验证,才能作为本产品的质量标准。
实验室小试制备样品可以用来开展主要药效学、药物代谢动力学研究,而安全评价研究的样品原则上要采用中试规模制备的样品,一则更能反映实际生产产品的安全性,二则只有中试规模制备的样品才能满足试验所需样品量。
当药物研发进入药学中试研究和药理毒理研究阶段,可以称为进入临床前研究阶段。在实验室药学研究阶段,或仅开展了初步的药效学或药物代谢动力学试验,尚不能称为临床前研究阶段。
本章仅介绍实验室研究与小试有关技术原理和规范要求,中试研究与药理毒理研究内容请见第九章“生物技术药物的质量控制、药理毒理研究与注册”。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




