乳酸菌(Lactic Acid Bacteria)是一类可发酵糖,主要产生大量乳酸的细菌的通称。乳酸菌需氧或兼性厌氧,多数无动力,过氧化氢酶阴性,革兰氏阳性,无芽孢杆菌或球菌。
乳酸菌在发酵食品中的应用非常广泛。它对人体健康有益,但需要达到一定的数量,才有可能到达并定植在人体肠道内,抑制有害菌的增殖和活动,维持肠道的微生态平衡。所以作为含活性乳酸菌的食品,应突出乳酸菌并保持一定的活菌数。由于产品中活乳酸菌的数量直接影响产品质量,因此乳酸菌计数已成为评价该类产品能否合格的重要指标。
在此依据《食品安全国家标准 食品微生物学检验 乳酸菌检验》(GB 4789.35—2010),介绍适用于含活性乳酸菌的食品中乳酸菌的检验方法。其中所指乳酸菌主要为乳杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)和链球菌属(Streptococcus)。
1.原理
乳酸菌菌落总数的测定主要是指检样通过处理,在一定条件下(如培养基、培养温度和培养时间等)进行涂布、培养后,所得1g或1mL检样中形成的乳酸菌菌落总数。
2.培养基
MRS(Man Rogosa Sharpe)培养基及莫匹罗星锂盐(Li-Mupirocin)改良MRS培养基、MC(Modified Chalmers)培养基、0.5%蔗糖发酵管、0.5%纤维二糖发酵管、0.5%麦芽糖发酵管、0.5%甘露醇发酵管、0.5%水杨苷发酵管、0.5%山梨醇发酵管、0.5%乳糖发酵管、七叶苷发酵管、革兰氏染色液、莫匹罗星锂盐(Li-Mupirocin)(化学纯)。
3.设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:
1)恒温培养箱:36℃±1℃。
2)冰箱:2~5℃。
3)均质器及无菌均质袋、均质杯或灭菌乳钵。
4)天平:感量为0.1g。
5)无菌试管:18mm×180mm、15mm×100mm。
6)无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及吸头。
7)无菌锥形瓶:容量为250mL、500mL。
4.检验程序
乳酸菌检验程序如图7-8-5所示。
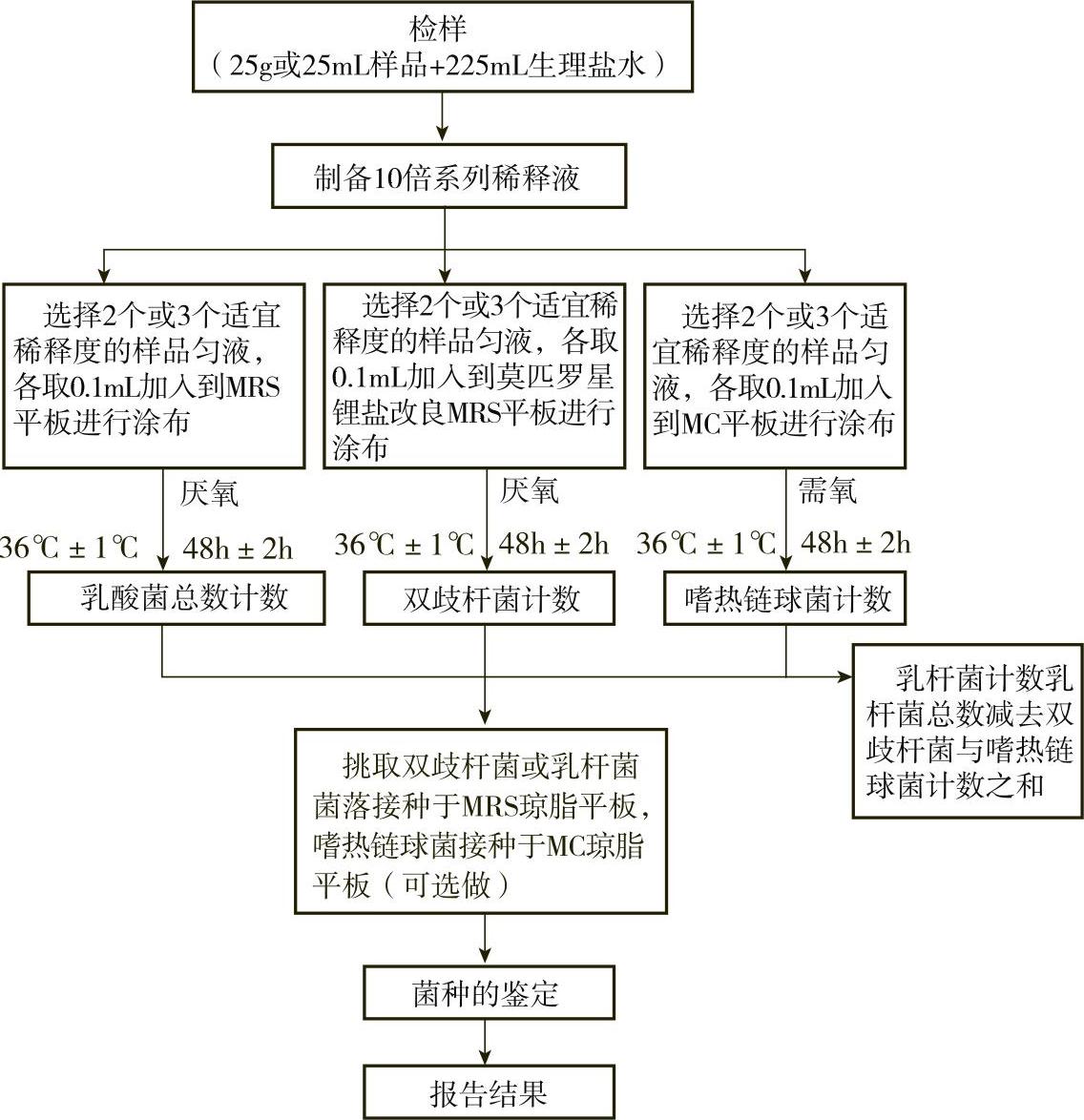
图7-8-5 乳酸菌检验程序
5.操作步骤
(1)样品的制备
1)冷冻样品:可先使其在2~5℃条件下解冻,时间不超过18h,也可在温度不超过45℃的条件下解冻,时间不超过15min。
2)固体和半固体食品:以无菌操作称取25g样品,置于装有225mL生理盐水的无菌均质杯内,以8000~10000r/min的转速均质1~2min,制成1∶10样品匀液;或置于225mL生理盐水的无菌均质袋中,用拍击式均质器拍打1~2min,制成1∶10的样品匀液。
3)液体样品:先将其充分摇匀,再以无菌吸管吸取样品25mL,放入装有225mL生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分振摇,制成1∶10的样品匀液。
(2)制备10倍系列稀释液
1)用1mL无菌吸管或微量移液器吸取1∶10样品匀液1mL,沿管壁缓慢注于装有9mL生理盐水的无菌试管中(吸管尖端不要触及稀释液),振摇试管或换用1支无菌吸管,反复吹打使其混合均匀,制成1∶100的样品匀液。
2)另取1mL无菌吸管或微量移液器吸头,按上述操作顺序,制作10倍递增样品匀液。每递增稀释一次,即换用1次1mL灭菌吸管或吸头。
(3)乳酸菌总数 根据待检样品活菌总数的估计,选择2个或3个连续的适宜稀释度,每个稀释度吸取0.1mL样品匀液分别置于2个MRS琼脂平板上,使用L形棒进行表面涂布,于36℃±1℃厌氧培养48h±2h后计数平板上的所有菌落数。从样品稀释到平板涂布要求在15min内完成。
(4)双歧杆菌计数 根据对待检样品双歧杆菌活菌总数的估计,选择2个或3个连续的适宜稀释度,每个稀释度吸取0.1mL样品匀液置于莫匹罗星锂盐改良MRS琼脂平板上,使用灭菌L形棒进行表面涂布,每个稀释度做两个平板,于36℃±1℃厌氧培养48h±2h后计数平板上的所有菌落数。从样品稀释到平板涂布要求在15min内完成。
(5)嗜热链球菌计数 根据待检样品嗜热链球菌活菌数的估计,选择2个或3个连续的适宜稀释度,每个稀释度吸取0.1mL样品匀液分别置于2个MC琼脂平板上,使用L形棒进行表面涂布,于36℃±1℃需氧培养48h±2h后计数。嗜热链球菌在MC琼脂平板上的菌落特征为:菌落中等偏小,边缘整齐光滑的红色菌落,直径为2mm±1mm,菌落背面为粉红色。从样品稀释到平板涂布要求在15min内完成。
(6)乳杆菌计数
用乳酸菌总数减去双歧杆菌与嗜热链球菌计数之和即得乳杆菌计数。
(7)菌落计数
1)可用肉眼观察,必要时用放大镜或菌落计数器,记录稀释倍数和相应的菌落数量。菌落计数以菌落形成单位CFU表示。
2)选取菌落数在30~300CFU之间,无蔓延菌落生长的平板计数菌落总数。低于30CFU的平板记录具体菌落数,大于300CFU的可记录为“多不可计”。每个稀释度的菌落数应采用两个平板的平均数。
3)其中一个平板有较大片状菌落生长时,不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的1/2,而其余1/2中菌落分布又很均匀,则可计算半个平板的菌落数后乘以2,代表一个平板菌落数。(https://www.xing528.com)
4)当平板上出现菌落间无明显界线的链状生长时,将每条单链作为一个菌落计数。
6.结果的表述
1)若只有一个稀释度平板上的菌落数在适宜计数范围内,则计算两个平板菌落数的平均值,再将平均值乘以相应的稀释倍数,作为每克或每毫升检样中的菌落总数结果。
2)若有两个连续稀释度的平板菌落数在适宜计数范围内,则按式(7-8-2)计算。
N=∑C/(n1+0.1n2)d (7-8-2)
式中 N——样品中菌落数;
C——平板(含适宜范围菌落数的平板)菌落数之和;
n1——第一稀释度(低稀释倍数)平板个数;
n2——第二稀释度(高稀释倍数)平板个数;
d——稀释因子(第一稀释度)。
3)若所有稀释度的平板上菌落数均大于300CFU,则对稀释度最高的平板进行计数,其他平板可记录为“多不可计”,结果按平均菌落数乘以最高稀释倍数计算。
4)若所有稀释度的平板菌落数均小于30CFU,则应按稀释度最低的平均菌落数乘以稀释倍数计算。
5)若所有稀释度(包括液体样品原液)平板均无菌落生长,则以小于1乘以最低稀释倍数计算。
6)若所有稀释度的平板菌落数均不在30~300CFU之间,其中一部分小于30CFU或大于300CFU,则以最接近30CFU或300CFU的平均菌落数乘以稀释倍数计算。
7.菌落数的报告
1)当菌落数小于100CFU时,按四舍五入原则修约,以整数报告。
2)当菌落数大于或等于100CFU时,第3位数字采用四舍五入原则修约后,取前两位数字,后面用0代替位数;也可用10的指数形式来表示,按四舍五入原则修约后,采用两位有效数字。
3)称重取样以CFU/g为单位报告,体积取样以CFU/mL为单位报告。
8.乳酸菌的鉴定(可选做)
(1)纯培养 挑取3个或以上单个菌落,嗜热链球菌接种于MC琼脂平板,乳杆菌属接种于MRS琼脂平板,于36℃±1℃厌氧培养48h。
(2)鉴定
1)双歧杆菌的鉴定按GB 4789.34—2012的规定操作。
2)涂片镜检:乳杆菌属的菌体形态多样,呈长杆状、弯曲杆状或短杆状,无芽孢,革兰氏染色阳性;嗜热链球菌菌体呈球形或球杆状,直径为0.5~2.0μm,成对或成链排列,无芽孢,革兰氏染色阳性。
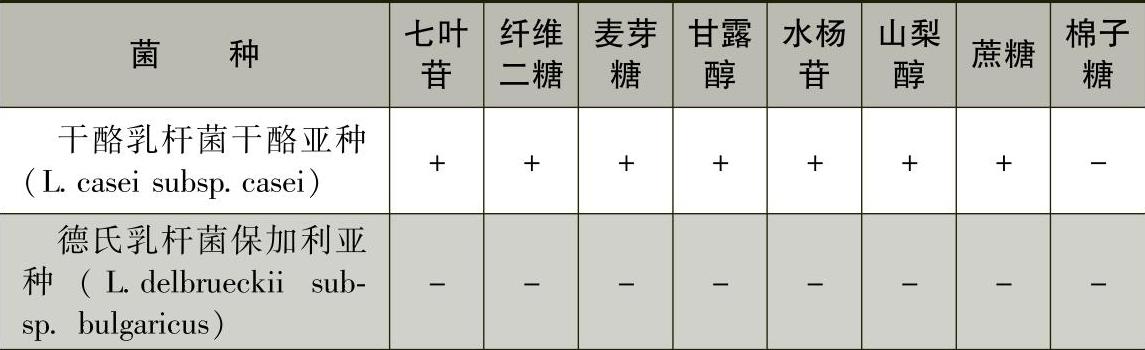
3)乳酸菌菌种主要生化反应见表7-8-1和表7-8-2。
表7-8-1 常见乳杆菌属的碳水化合物反应
(续)
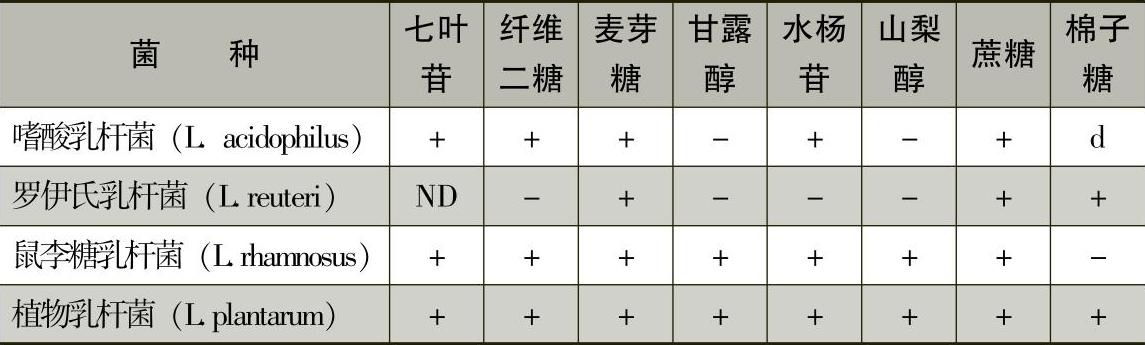
注:+表示90%以上的菌株阳性;-表示90%以上的菌株阴性;d表示11%~89%的菌株阳性;ND表示未测定。
表7-8-2 嗜热链球菌的主要生化反应

注:+表示90%以上的菌株阳性;-表示90%以上的菌株阴性。
9.注意事项
1)倾倒培养基时要适量,一般在15~20mL之间,避免因涂布平板的培养基不够而影响乳酸菌的培养。
2)制备10系列稀释液时,要将不同倍数的稀释液振荡均匀,以免影响测定结果。
3)每递增稀释一次,必须另换1支1mL灭菌吸管,这样所得检样的稀释倍数才准确。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




