大肠菌群是根据卫生学方面的要求,提出的与粪便污染有关的细菌。这些细菌在生化及血清学方面并非完全一致。根据进一步的生化试验,可将这群细菌再分为埃希氏菌属、柠檬酸杆菌属、克雷伯氏菌属和肠杆菌属等。
检查大肠菌群数,一方面能表明食品中有无粪便污染,另一方面还可以根据其数量,判定食品受污染的程度,同时间接地指出食品是否有肠道致病菌污染的可能性。该菌主要来源于粪便,故以此作为粪便污染指标来评价食品的卫生质量,具有广泛的卫生学意义。
在此依据《食品安全国家标准 食品微生物学检验 大肠菌群计数》(GB 4789.3—2010),介绍适用于食品中大肠菌群计数的方法。
1.原理
大肠菌群是指在一定培养条件下能发酵乳糖、产酸产气的需氧和兼性厌氧革兰氏阴性无芽孢杆菌。食品中大肠菌群的计数方法主要有MPN法和平板计数法。MPN法是基于泊松分布的一种间接计数法,以每克或每毫升检样内大肠菌群最近似数(Most Probable Number,MPN)表示。平板计数法是指食品检样经过处理,在一定条件下(如培养基、培养温度和培养时间等)培养后,挑取不同类型的典型和可疑菌落,移种于BGLB肉汤管内培养,对所得每克或每毫升检样中形成的大肠菌群计数。
2.培养基和试剂
1)月桂基硫酸盐胰蛋白胨(Lauryl Sulfate Tryptose,LST)肉汤。
2)煌绿乳糖胆盐(Brilliant Green Lactose Bile,BGLB)肉汤。
3)结晶紫中性红胆盐琼脂(Violet Red Bile Agar,VRBA)。
4)磷酸盐缓冲液。
5)无菌生理盐水。
6)无菌1mol/L的NaOH。
7)无菌1mol/L的HCl。
3.设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:
1)恒温培养箱:36℃±1℃。
2)冰箱:2~5℃。
3)恒温水浴箱:46℃±1℃。
4)天平:感量为0.1g。
5)均质器。
6)振荡器。
7)无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及吸头。
8)无菌锥形瓶:容量为500mL。
9)无菌平皿:直径为90mm。
10)pH计或pH比色管或精密pH试纸。
11)菌落计数器。
4.计数方法
(1)大肠菌群MPN计数法(第一法)
1)检验程序:大肠菌群MPN计数法的检验程序如图7-8-2所示。
2)操作步骤
①检样的稀释(https://www.xing528.com)
a.固体和半固体样品:称取25g样品,放入盛有225mL磷酸盐缓冲液或生理盐水的无菌均质杯内,以8000~10000r/min的转速均质1~2min,或放入盛有225mL磷酸盐缓冲液或生理盐水的无菌均质袋中,用拍击式均质器拍打1~2min,制成1∶10的样品匀液。
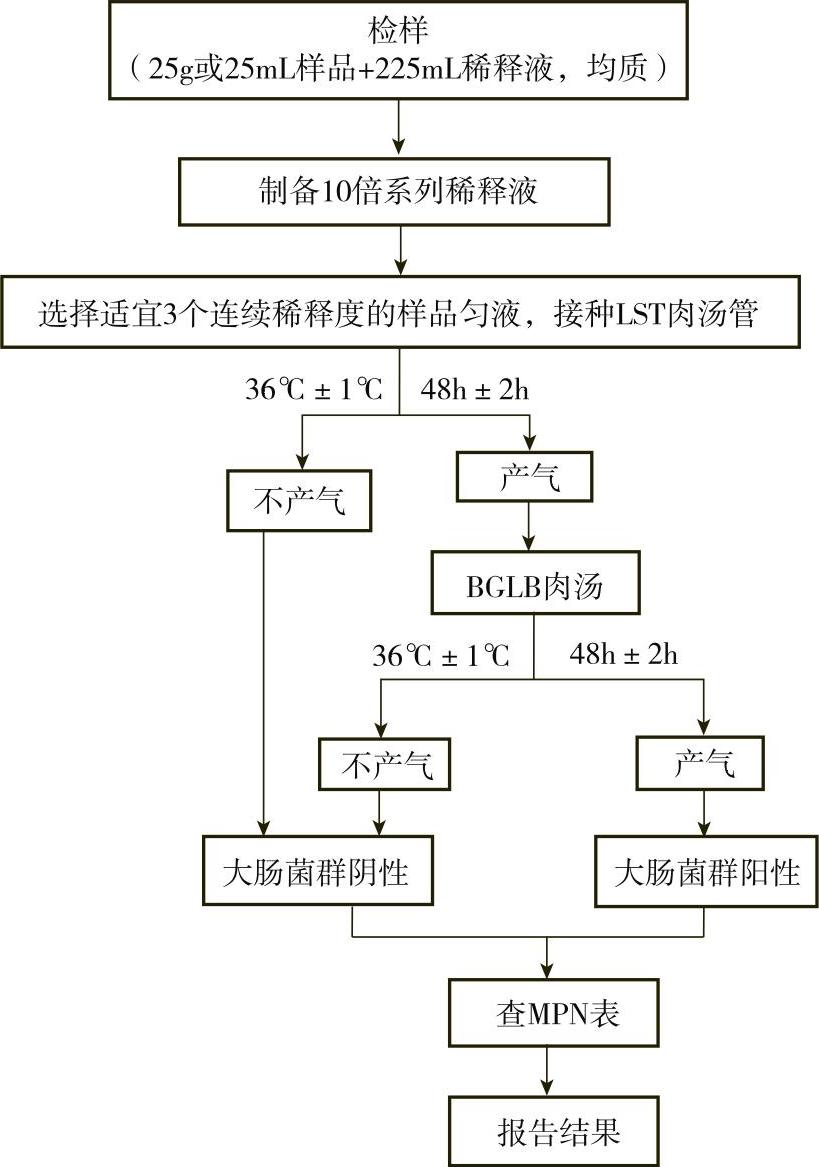
图7-8-2 大肠菌群MPN计数法的检验程序
b.液体样品:以无菌吸管吸取25mL样品,加入盛有225mL磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1∶10的样品匀液。
c.样品匀液的pH值应控制在6.5~7.5之间,必要时分别用1mol/L的NaOH或1mol/L的HCl进行调节。
d.用1mL无菌吸管吸取1∶10样品匀液1mL,沿管壁缓缓注入盛有9mL磷酸盐缓冲液或生理盐水的无菌试管中(吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支1mL无菌吸管反复吹打,使其混合均匀,制成1∶100的样品匀液。
e.根据对样品污染状况的估计,按上述操作,依次制成10倍递增系列稀释样品匀液。每递增稀释1次,换用1支1mL无菌吸管。
②初发酵试验
每个样品,选择3个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管接种1mL,于36℃±1℃条件下培养24h±2h,观察倒管内是否有气泡产生。若产气,则需要进行复发酵试验;若未产气,则继续培养至48h±2h。产气者进行复发酵试验,未产气者为大肠菌群阴性。
③复发酵试验
用接种环从产气的LST肉汤管中分别取培养物1环,移种于煌绿乳糖胆盐肉汤(BGLB)管中,于36℃±1℃培养48h±2h,观察产气情况。产气者,计为大肠菌群阳性。
3)大肠菌群最可能数(MPN)的报告:按复发酵试验确证的大肠菌群LST阳性管数,检索MPN表(见附录A),报告每克或每毫升样品中大肠菌群的MPN值。
(2)大肠菌群平板计数法(第二法)
1)检验程序:大肠菌群平板计数法的检验程序如图7-8-3所示。
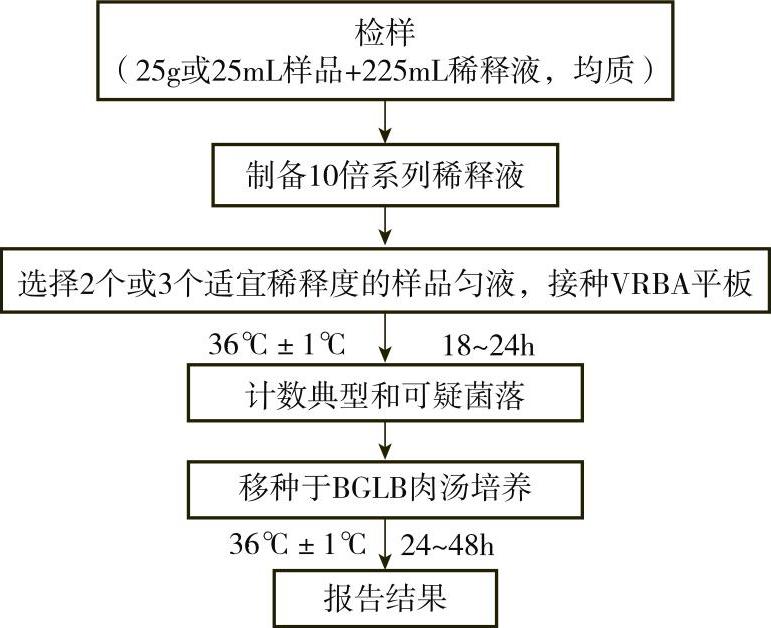
图7-8-3 大肠菌群平板计数法的检验程序
2)操作步骤
①样品的稀释按MPN计数法进行。
②平板计数
a.选取2个或3个适宜的连续稀释度,每个稀释度接种2个无菌平皿,每皿1mL。同时取1mL生理盐水加入无菌平皿作空白对照。
b.及时将15~20mL冷至46℃的结晶紫中性红胆盐琼脂(VRBA)倾注于每个平皿中。小心旋转平皿,将培养基与样液充分混匀,待琼脂凝固后,再加3~4mLVRBA覆盖平板表层,翻转平板,置于36℃±1℃培养18~24h。
c.平板菌落数的选择:选取菌落数在15~150CFU之间的平板,分别对平板上出现的典型和可疑大肠菌群菌落进行计数。典型的菌落为紫红色,菌落周围有红色的胆盐沉淀环,菌落直径为0.5mm或更大。
③证实试验:从VRBA平板上挑取10个不同类型的典型和可疑菌落,分别移种于BGLB肉汤管内,于36℃±1℃培养24~48h,观察产气情况。只要BGLB肉汤管产气,就可报告为大肠菌群阳性。
3)大肠菌群平板计数的报告:经最后证实为大肠菌群阳性的试管比例乘以“平板菌落数的选择”中计数的平板菌落数,再乘以稀释倍数,即为每克或每毫升样品中的大肠菌群数。例如:1mL 10-4样品稀释液,在VRBA平板上有100个典型和可疑菌落,挑取其中的10个接种BGLB肉汤管,证实有6个阳性管,则该样品的大肠菌群数为100×6/10×104/g(mL)=6.0×105CFU/g(mL)。
5.注意事项
1)初发酵试验时,每管接种量为1mL,若超过1mL,则要用双料LST肉汤。
2)在初发酵试验过程中,有时可以看到在发酵管内存有极微小的气泡(有时比小米粒还小)。一般来说,产气量与大肠菌群检出率呈正相关,但因样品种类不同而不同,有小于米粒的气泡也可有阳性检出。有时也可遇到在初发酵时产酸无气,但复发酵却证实为大肠菌群阳性情形。倒管内虽无气体,但在液面及管壁上却可以看到缓缓上浮的小气泡。所以,若对未产气的LST肉汤发酵管有疑问,则可以用手轻轻打动试管,当有气泡沿管壁上浮时,即应考虑可能有气体产生,而应做进一步观察。
3)最可能数(MPN)是表示对样品中活菌密度的估测。MPN检索表采用三个稀释度[0.1g(mL)、0.01g(mL)和0.001g(mL)],每个稀释度接种3管(即九管法)。稀释度的选择基于对样品中菌数的估测。较理想的结果应是最低稀释度3管为阳性,而最高稀释度3管为阴性。如果无法估测样品中的菌数,则应做一定范围的稀释度。MPN检索表列出了95%可信限供参考。
4)LST、BGLB等培养基在灭菌时,小导管中有时出现气泡排不尽的现象。其主要原因:一是分装LST、BGLB时,小导管中有水柱;二是高压灭菌时,需急排气,而灭菌后又迅速冷却。
5)观察气泡时,要对光倾斜试管,使小导管紧贴在试管壁上,便于观察。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




