菌落总数主要作为判别食品被污染程度的标志。它反映食品在生产、加工、销售过程中是否符合卫生要求,以便对被检样品做出适当的卫生学评价。也可以应用这一方法观察食品中细菌的性质以及细菌在食品中繁殖的动态。细菌菌落总数的测定一般用国际标准规定的平板计数法,所得结果只包含一群能在营养琼脂上生长的嗜中温需氧菌的菌落总数,并不表示样品中实际存在的所有细菌菌落总数。由于菌落总数并不能区分细菌的种类,故常被称为杂菌数或需氧菌数等。食品中菌落总数越多,说明食品质量越差,病原菌污染的可能性越大。
依据国标《食品安全国家标准 食品微生物学检验 菌落总数测定》(GB 4789.2—2010),介绍适用于食品中菌落总数测定的方法。
1.原理
菌落总数是指食品检样经过处理,在一定条件下(如培养基、培养温度和培养时间等)培养后,所得每克或每毫升检样中形成的微生物菌落总数。菌落是细菌在固体培养基上生长繁殖而形成的能被肉眼识别的生长物,是由数以万计相同的细菌集合而成的。当样品被稀释到一定程度时,与培养基混合,在一定培养条件下,每个能够生长繁殖的细菌细胞都可以在平板上形成一个可见的菌落。
2.培养基和试剂
平板计数琼脂培养基、磷酸盐缓冲液、无菌生理盐水。
3.设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:
1)恒温培养箱:36℃±1℃,30℃±1℃。
2)冰箱:2~5℃。
3)恒温水浴箱:46℃±1℃。
4)天平:感量为0.1g。
5)均质器。
6)振荡器。
7)无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及吸头。
8)无菌锥形瓶:容量为250mL、500mL。
9)无菌培养皿:直径为90mm。
10)pH计或pH比色管或精密pH试纸。
11)放大镜或/和菌落计数器。
4.菌落总数的检验程序
菌落总数的检验程序如图7-8-1所示。
5.操作步骤
(1)检样的稀释
1)固体和半固体样品:称取25g样品放入到盛有225mL磷酸盐缓冲液或生理盐水的无菌均质杯内,以8000~10000r/min的转速均质1~2min,或放入盛有225mL稀释液的无菌均质袋中,用拍击式均质器拍打1~2min,制成1∶10的样品匀液。
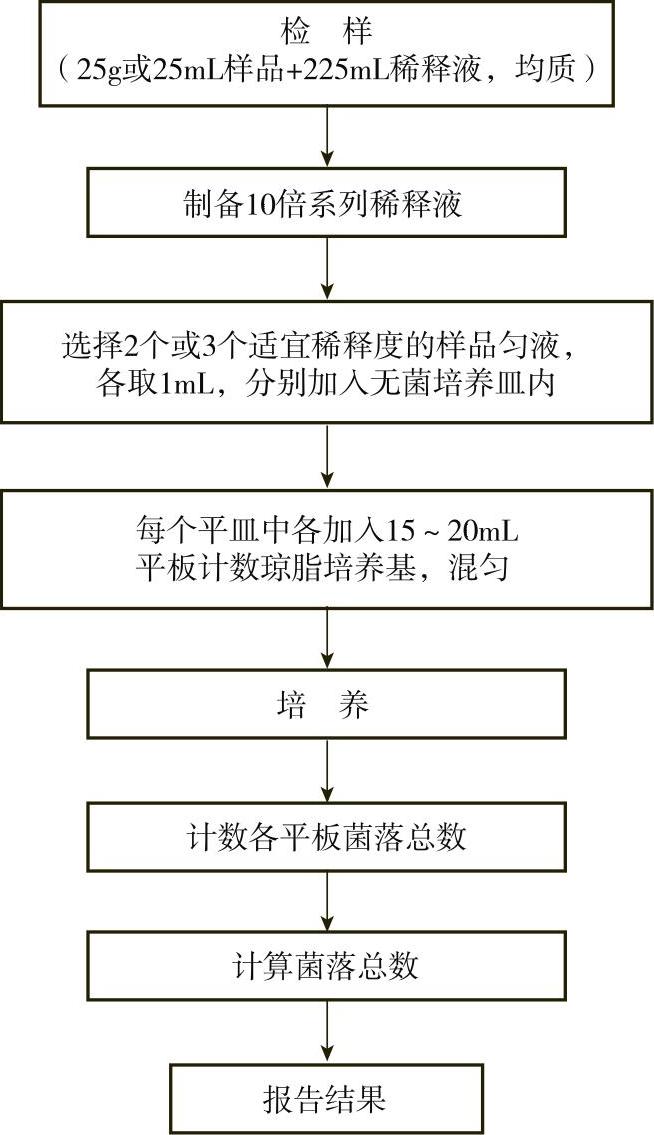
图7-8-1 菌落总数的检验程序
2)液体样品:以无菌吸管吸取25mL样品,加入到盛有225mL磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1∶10的样品匀液。
3)用1mL无菌吸管吸取1∶10样品匀液1mL,沿管壁缓慢注于盛有9mL稀释液的无菌试管中(吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支无菌吸管反复吹打,使其混合均匀,制成1∶100的样品匀液。
4)按3)的操作程序,制备10倍系列稀释样品匀液。每递增稀释一次,换用1次1mL无菌吸管或吸头。
5)根据对样品污染状况的估计,选择2个或3个适宜稀释度的样品匀液(液体样品可包括原液),从中分别吸取1mL置于无菌平皿内,每个稀释度做两个平皿。同时,分别吸取1mL空白稀释液,加入两个无菌平皿内作空白对照。
6)及时将15~20mL冷却至46℃的平板计数琼脂培养基(可放置于46℃±1℃恒温水浴箱中保温)倾注平皿,并转动平皿使其混合均匀。
(2)培养
1)待琼脂凝固后,将平板翻转,置于36℃±1℃恒温培养箱内培养48h±2h。水产品的培养条件与其他食品不同,其培养温度为30℃±1℃,时间为72h±3h。
2)如果样品中可能含有在琼脂培养基表面弥漫生长的菌落,则可在凝固后的琼脂表面覆盖一薄层琼脂培养基(约4mL),凝固后翻转平板,按1)的条件进行培养。
(3)菌落计数方法
在对平皿内的菌落进行计数时,可用肉眼观察,必要时用放大镜,以防遗漏,有条件时还可以用菌落计数器。记录稀释倍数和相应的菌落数量。菌落计数以菌落形成单位(Colony-Forming Units,CFU)表示。
1)选取菌落数在30~300CFU之间,无蔓延菌落生长的平板计数菌落总数。低于30CFU的平板记录具体菌落数,大于300CFU的可记录为“多不可计”。每个稀释度的菌落数应采用两个平板的平均数。
2)当其中一个平板有较大片状菌落生长时,不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的1/2,而其余1/2中菌落分布又很均匀,则可计算半个平板的菌落数后乘以2,代表一个平板的菌落数。(https://www.xing528.com)
3)当平板上出现菌落间无明显界线的链状生长时,将每条单链作为一个菌落计数。
6.菌落计数结果与报告
(1)菌落总数的计算方法
1)若只有一个稀释度平板上的菌落数在适宜计数的范围内,则计算两个平板菌落数的平均值,再将平均值乘以相应的稀释倍数,作为每克或每毫升样品中的菌落总数。
2)若有两个连续稀释度的平板菌落数在适宜计数的范围内,则按式(7-8-1)计算。
N=∑C/(n1+0.1n2)d (7-8-1)
式中 N——样品中菌落数;
ΣC——平板(含适宜范围菌落数的平板)菌落数之和;
n1——第一稀释度(低稀释倍数)平板个数;
n2——第二稀释度(高稀释倍数)平板个数;
d——稀释因子(第一稀释度)。
示例:

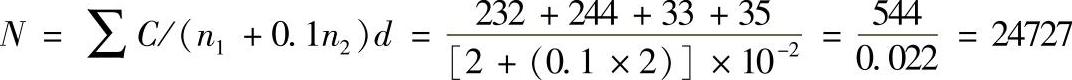
上述数据修约后,表示为25000或2.5×104。
3)若所有稀释度的平板上菌落数均大于300CFU,则对稀释度最高的平板进行计数,其他平板可记录为“多不可计”,结果按平均菌落数乘以最高稀释倍数计算。
4)若所有稀释度的平板菌落数均小于30CFU,则应按稀释度最低的平均菌落数乘以稀释倍数计算。
5)若所有稀释度(包括液体样品原液)的平板均无菌落生长,则以小于1乘以最低稀释倍数计算。
6)若所有稀释度的平板菌落数均不在30~300CFU之间,其中一部分小于30CFU或大于300CFU,则以最接近30CFU或300CFU的平均菌落数乘以稀释倍数计算。
(2)菌落总数的报告
1)当菌落数小于100CFU时,按四舍五入原则修约,以整数报告。
2)当菌落数大于或等于100CFU时,第3位数字采用四舍五入原则修约后,取前两位数字,后面用0代替位数;也可用10的指数形式来表示,按四舍五入原则修约后,采用两位有效数字。
3)若所有平板上为蔓延菌落而无法计数,则报告菌落蔓延。若空白对照上有菌落生长,则此次检测结果无效。
4)称重取样以CFU/g为单位报告,体积取样以CFU/mL为单位报告。
5)将试验测出的样品数据以报表方式报告结果,对样品细菌总数做出是否符合食品卫生要求的结论。
7.注意事项
1)检验中所用玻璃器皿必须是完全灭菌的,如培养皿、吸管、试管必须是完全灭菌的,并在灭菌前彻底清洗干净,不得残留抑制物质。整个检验的所有过程应按无菌操作进行。
2)用于样品稀释的液体,每批都要有空白对照。如果在琼脂对照平板上出现菌落,要查找原因,可通过追加对照平板,以判定是否为稀释液、培养基、平皿、吸管或空气存在污染。
3)每递增稀释一次,必须另换1支1mL灭菌吸管,这样所得检样的稀释倍数才准确。
4)为防止细菌增殖产生片状菌落,在将检液加入平皿后,应在20min内倾入琼脂,并立即使之与琼脂混合均匀。
5)如果样品中可能含有在琼脂培养基表面弥漫生长的菌落,则可在凝固后的琼脂表面覆盖一薄层琼脂培养基(约4mL),凝固后翻转平板,再按其培养条件进行培养。
6)加入平皿内的检样稀释液有时带有检样颗粒,为了避免与细菌菌落发生混淆,可做一检样稀释液与琼脂混合的平皿,不经培养,于4℃环境中放置,以便在计数检样菌落时用作对照。
7)检样若为微生物类制剂(如乳酒),则平板计数中应相应地将有关微生物排除,不可并入检样的菌落总数中报告结果。
8)检样的稀释液虽可用灭菌盐水或蒸馏水,但以用磷酸盐缓冲溶液为合适,因其对细菌细胞有更好的保护作用,不会在稀释过程中使食品检样中原已受损伤的细菌细胞死亡。如果对含盐量较高的食品(如酱品等)进行稀释,则宜采用蒸馏水。
9)在制备10倍系列稀释液的过程中,应注意吸管插入检样稀释液内的部分不能低于液面2.5cm,吸入液体时,应先高于吸管刻度,然后提起吸管尖端,使其离开液面,将尖端贴于内壁,将吸管内液面调至所要求的刻度。
10)检样与琼脂混合时,可将皿底在平面上先向一个方向旋转,然后再向相反的方向旋转,以使其充分混匀。旋转时应加小心,不要使混合物溅到皿边的上方。
11)如果稀释度大的平板上菌落数反比稀释度小的平板上菌落数高,则可能为检验工作中出现差错,属于试验事故,也可能是抑菌剂混入样品中所致,均不可用作检样计数报告的依据。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




