1.吸光度与透光度
当光线通过均匀、透明的溶液时可出现三种情况:一部分光被散射,一部分光被吸收,另有一部分光透过溶液(见图5-1-1)。设入射光强度为I0,透射光强度为It,则It和I0之比称为透光度(T)。T×100为T%,称为百分透光度。
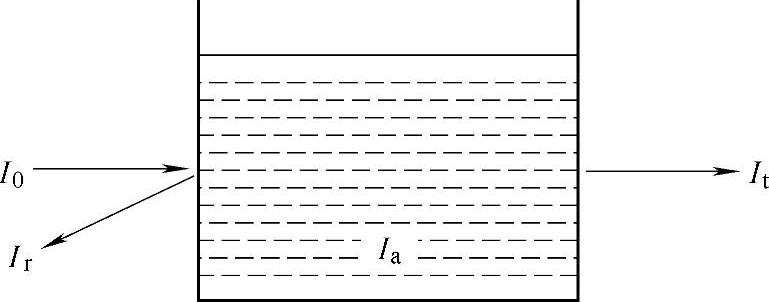
图5-1-1 光通过溶液示意图
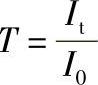
透光度的负对数称为吸光度,即
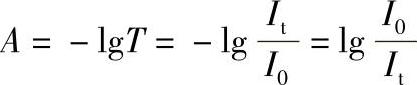
A值越大,表示物质对光的吸收程度越大。分光光度法既可以测定液体样品,也可以测定固体样品和气体样品,但一般都将样品制成溶液进行测量。
2.Lambert-Beer定律
Lambert-Beer定律是讨论溶液吸光度与溶液浓度和液层厚度之间关系的基本定律,是吸光光度分析的理论基础。其表达式为
A=Kbc
式中 A——吸光度;
K——比例常数,称为吸光系数;(https://www.xing528.com)
b——液层厚度,称为光径;
c——溶液浓度。
Lambert-Beer定律适用于可见光、紫外光、红外光和均匀非散射的液体。根据Lambert-Beer定律,当液层厚度单位为cm,浓度单位为mol/L时,吸光系数K称为摩尔吸光系数(ε),单位为L/(mol·cm)。ε的意义是:当液层厚度为1cm,浓度为1mol/L时,在特定波长下的吸光度。ε反映吸光物质对光的吸收能力,也反映可用吸光光度法测定该吸光物质的灵敏度。在一定条件下,某吸光物质的ε值为一常数。同一物质与不同显色剂反应生成不同有色化合物时,具有不同的ε值。因此,ε值是选择显色反应的重要依据。
3.偏离Lambert-Beer定律的因素
根据Lambert-Beer定律,A与c的关系应是一条通过原点的直线,称为标准曲线,但事实上往往容易发生偏离直线的现象而引起误差(见图5-1-2),尤其在高浓度时。此种偏离主要来源于Lambert-Beer定律本身的局限性、化学因素和光学因素等。
(1)Lambert-Beer定律本身的局限性 Lambert-Beer定律适用于浓度小于0.01mol/L的稀溶液。吸光系数与浓度无关,但与折射率有关。在高浓度时,由于折射率随着浓度的增加而增加,因此,引起偏离Lambert-Beer定律。
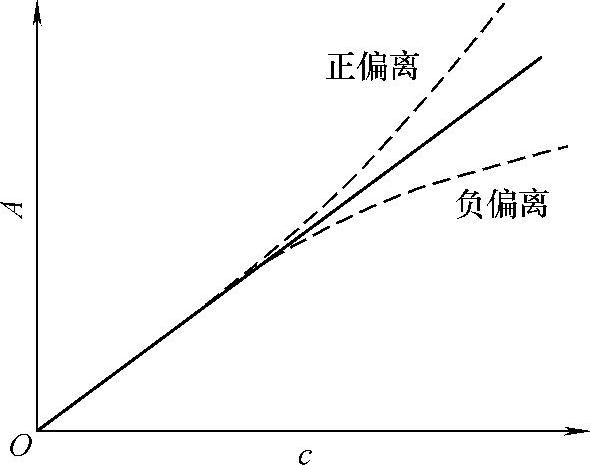
图5-1-2 标准曲线及对Lambert-Beer定律的偏离
入射光通过具有不同折射率的两种介质的界面时,会发生反射作用。若被测溶液的折射率和空白溶液的折射率基本相同,则发射作用的影响互相抵消。当被测溶液的浓度增加时,两者的差异增大,校正曲线不通过零点。为了校正或消除这种差异,测定时可用空白溶液做相对校正。空白溶液应与被测溶液的组成相近,且两者应装入大小、形状和材料相同的吸收池中。
(2)化学因素 溶液对光的吸收程度取决于吸光物质的性质和数目。若溶液中发生了电离、酸碱反应、配位反应等,则会改变吸光物质的浓度,导致偏离Lambert-Beer定律。若化学反应使吸光物质浓度降低,而产物在测量波长处不吸收,则会引起负偏离;若产物比原吸光物质在测量波长处的吸收更强,则会引起正偏离。
(3)光学因素 Lambert-Beer定律要求入射光是单色光。但在目前的分光条件下,能分出的单色光并不是严格的单色光,而是包括一定波长范围的光谱带(此波长范围即谱带宽度)。其他波长的杂色光是引起误差的主要原因。入射光的谱带越宽,其误差越大。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




