缓冲溶液通常是由足够浓度的弱酸及其共轭碱、弱碱及其共轭酸或多元酸的酸式盐及其次级盐组成的,具有抵抗外加的少量强酸或强碱,或适当稀释而保持溶液pH值基本不变的作用。
1.缓冲溶液的组成和缓冲作用的原理
缓冲溶液通常由弱酸与弱酸盐(共轭碱)(如CH3COOH-CH3COONa)、弱碱与弱碱盐(共轭酸)(NH3-NH4Cl)、多元弱酸的酸式盐及次级盐(Na2CO3-NaHCO3)组成。
下面以CH3COOH-CH3COONa组成的缓冲溶液为例,说明其缓冲作用的原理。这种缓冲溶液的特点是:体系中同时含有大量的CH3COOH和CH3COO-,并存在着CH3COOH的解离平衡。

当外加少量酸时,溶液中的CH3COO-瞬间即与外加的H+结合成CH3COOH,使CH3COOH的解离平衡向左移动,溶液中H+的浓度几乎不变,这里CH3COO-起到了抗酸的作用;当外加少量碱时,溶液中的H+与OH-结合生成H2O,使CH3COOH的解离平衡向右移动,即大量存在的未解离的CH3COOH就继续解离以补充H+的消耗,溶液中OH-的浓度几乎不变,这里CH3COOH起到了抗碱的作用。显然,缓冲溶液同时具有抗少量酸、碱的作用,并且由缓冲溶液的不同部分承担。
2.缓冲溶液pH值的计算
假设一元弱酸与弱酸盐HA-MA组成缓冲溶液,一元弱酸的浓度为c酸,弱酸盐的浓度为c盐,由HA解离得[H+]=xmol/L
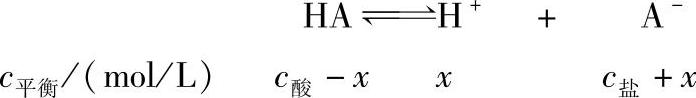
由于HA的解离度很小,加入NaA后,存在同离子效应,解离出来的H+和A-浓度更小,所以0.10±x≈0.10。
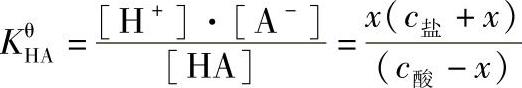
由于HA为弱酸,且存在同离子效应,H+浓度更小,所以c酸-x≈c酸,c盐+x≈c盐,则

对于任意一元弱酸-弱酸盐:
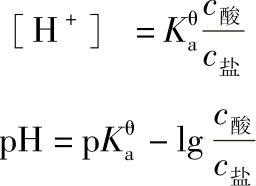
同理,也可推导出一元弱碱与弱碱盐pH值的计算公式为
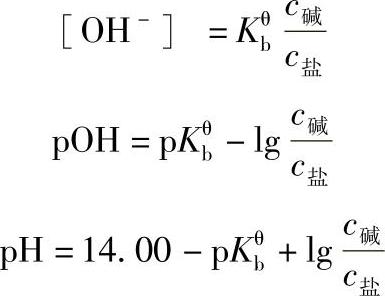
3.关于缓冲溶液的几点说明
1)缓冲溶液的pH值主要取决于弱酸或弱碱的解离平衡常数Kθa或Kbθ;选择缓冲对时,应使pKaθ和pKθb尽量接近pH、pOH。
2)缓冲溶液pH值的控制主要体现在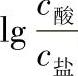 或
或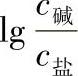 ,外加少量酸、碱时,
,外加少量酸、碱时,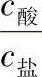 或
或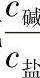 的值改变不大,因此pH值改变不大。
的值改变不大,因此pH值改变不大。
3)缓冲溶液的缓冲能力主要与弱酸(弱碱)及其盐的浓度有关。弱酸(弱碱)浓度大,比值改变小,pH值变化小。缓冲能力还与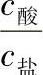 或
或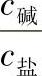 有关,比值接近于1时,缓冲能力最大,一般比值在0.1~10之间。
有关,比值接近于1时,缓冲能力最大,一般比值在0.1~10之间。
4)各种缓冲溶液只能在一定范围内(pH=pKaθ±1)发挥缓冲作用。选择缓冲溶液时应注意其缓冲范围。(https://www.xing528.com)
5)将缓冲溶液适当稀释,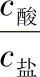 或
或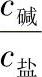 的比值不变,故溶液pH值不变。
的比值不变,故溶液pH值不变。
4.缓冲溶液的配制
【例1-5-8】欲配制pH值为5.00,乙酸浓度为0.10mol/L的缓冲溶液1.0L,求所需固体乙酸钠(CH3COONa·3H2O)的质量以及所需浓度为0.5mol/L的CH3COOH溶液的体积。
解 已知pH=5.00,即[H+]=1.0×10-5mol/L,c酸=0.10mol/L,代入
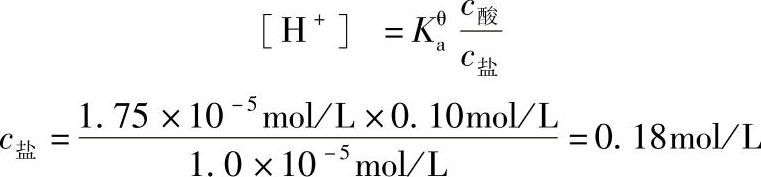
则所需CH3COONa·3H2O的质量为
1.0L×0.18mol/L×136g/mol≈24g
所需0.5mol/L CH3COOH溶液的体积为

计算出所需CH3COOH和CH3COONa的量之后,先将24gCH3COONa·3H2O放于少量水中,使其溶解,再加入0.5mol/L的CH3COOH溶液0.20L,然后用水稀释至1.0L,即得pH值为5.00的缓冲溶液。
【例1-5-9】如何配制100mL pH值为5.00的缓冲溶液?
解 缓冲溶液的pH值为5.00,而CH3COOH的pKaθ=4.76,所以可选用CH3COOH-CH3COONa缓冲对。设使用相同浓度的CH3COOH和CH3COONa溶液,CH3COONa溶液体积为VmL,CH3COOH溶液体积为(100-V)mL,则

答 需CH3COONa溶液63.3mL,CH3COOH溶液的体积为100mL-63.3mL=36.7mL。
选择适当的相同浓度的CH3COOH溶液36.7mL和CH3COONa溶液63.3mL混合,即可得到需要的缓冲溶液。
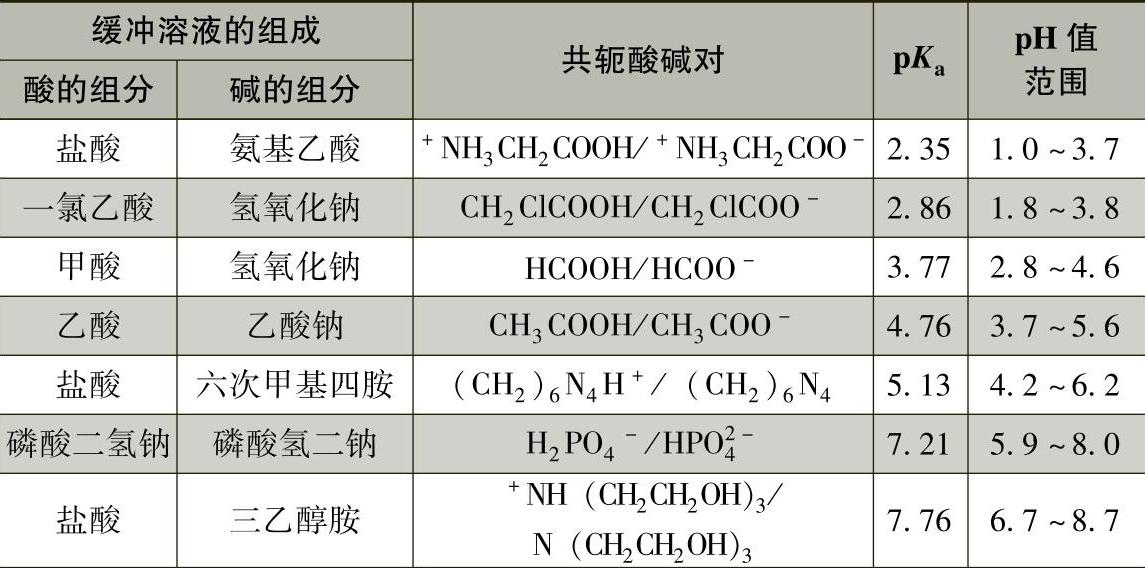
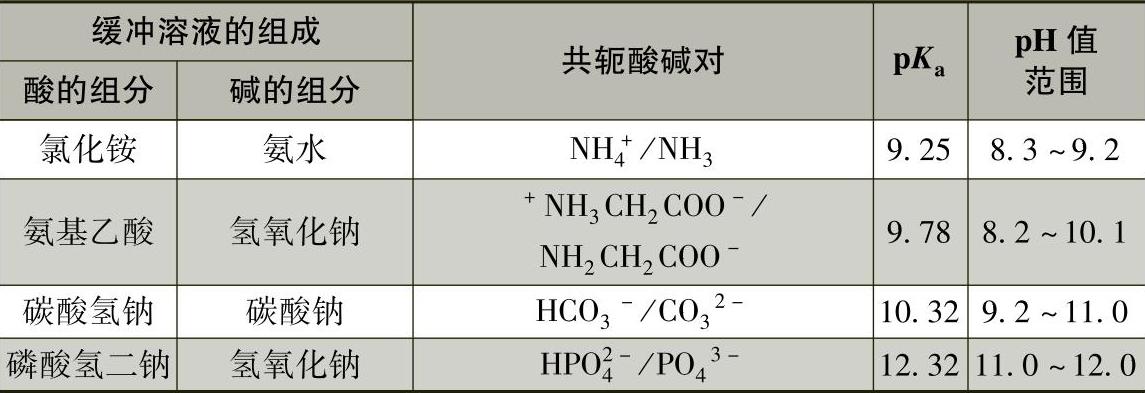
常用的酸碱缓冲溶液可控制的pH值范围见表1-5-4。
表1-5-4 常用的酸碱缓冲溶液可控制的pH值范围
(续)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




