10.1.4.1 环境介质因素
1.氧化剂与溶解氧 水溶液中的H+、H2O以及溶解氧(O2)都是氧化剂。此外,存在其中的阳离
化剂。氧化剂对腐蚀的影响一是决定于氧化还原反应时的平衡电位(E0)及金属溶解平衡电位(Ea),当E0>Ea时氧化剂对腐蚀无影响;二是决定于金属特性,非钝化型金属(例如Cu)随氧化剂浓度升高而加快腐蚀。氧化剂对钝化型金属的影响较复杂,与钝化电位(ECr)、钝化电流(ICr)及阴极反应电流(IC)有关。当E0<ECr时金属处于活性状态,氧化剂的影响与非钝化型金属相同;当E0>ECr,但IC<ICr时仍不能产生钝化,当IC≥ICr时将进入钝化状态,此时氧化剂对金属腐蚀的影响大大减小。但是过钝化后,腐蚀速度又有增大。两种氧化剂共存时比单一氧化剂影响大。
蒸馏水中氧含量对低碳钢腐蚀的影响如图10-5所示。蒸馏水中溶有12mL/L氧时腐蚀速度达到最大值。溶解氧数量再增加,由于金属产生钝化,使腐蚀速度降低。当水中不含氧时室温下的腐蚀可忽略。
2.温度的影响 无论阳极反应或阴极反应,随温度升高,反应速度都会加快。低温下(低于80℃),在敞开容器中,随温度升高溶解氧增多,加速腐蚀。温度超过80℃后溶解氧减少,对腐蚀影响也减少。然而金属在封闭容器中时,随温度升高,腐蚀速度一直增加。
3.pH值的影响 金属腐蚀与阳极上的H+、OH-反应有关,因此溶液的pH值对腐蚀速度有影响。酸性溶液中是氢去极化腐蚀,腐蚀速度随pH值增加而减小。中性溶液中氧去极化反应为主,金属腐蚀受溶解氧的影响,而pH值对腐蚀速度无影响。在碱性溶液中常常发生钝化,随pH值增加腐蚀速度降低。图10-6所示为pH值对Fe腐蚀速度的影响。图10-7所示为纯水在不同温度下的pH值。表10-6是一些溶液在25℃时的pH近似值。

图10-5 蒸馏水中氧含量对低碳钢腐蚀的影响(25℃,48h)

图10-6 pH值对Fe腐蚀速度的影响
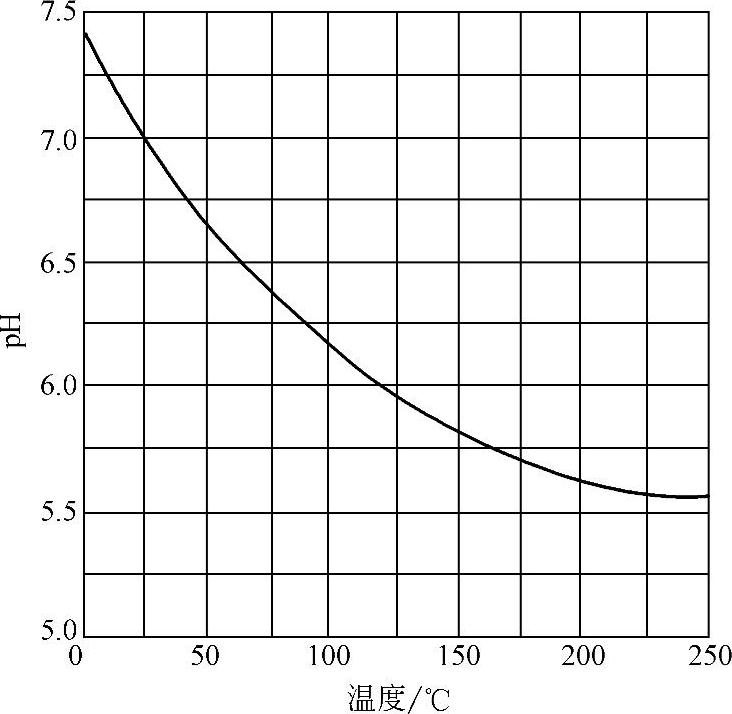
图10-7 纯水在不同温度下的pH值
表10-6 在25℃时一些溶液的pH近似值

4.水中所含物质的影响
(1)淡水。淡水中含有Ca盐及Mg盐等。含盐量多的称为硬水,少的为软水。硬水比软水对金属腐蚀作用小,因为淡水是阴极去极化腐蚀为主,水中的CaCO3在阴极表面形成膜,阻碍溶解氧向阴极扩散。
水中含盐量不同对金属的腐蚀程度也不同,含量低时随盐量增加腐蚀程度增大,达到一定含量后,腐蚀程度减轻。其原因是随盐量增加,导电性增大,加速腐蚀。含盐量高时溶解氧减少,减轻腐蚀,如图10-8、图10-9所示。

图10-8 盐类含量对碳钢[w(C)=0.06%]腐蚀的影响 (35℃,48h,试样表面积为17.5cm2)
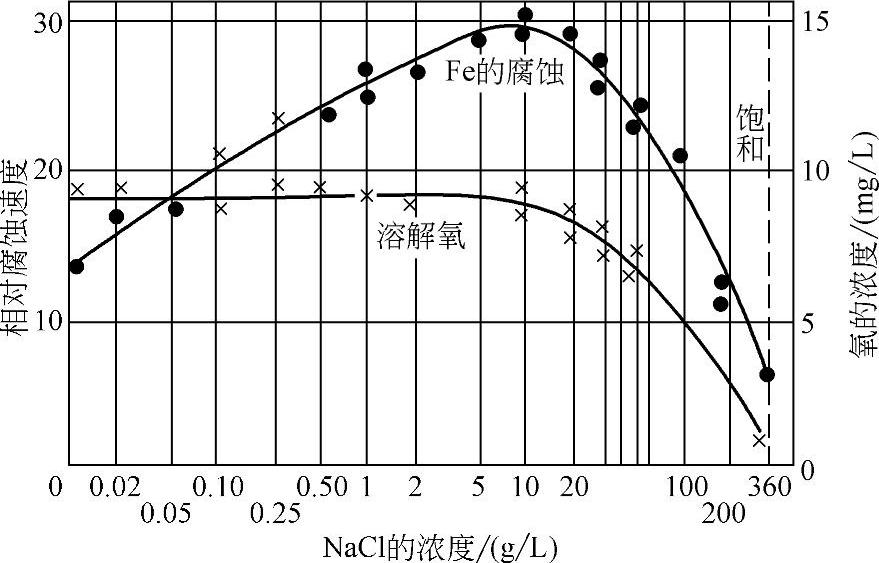
图10-9 NaCl含量及溶解氧数量对Fe腐蚀的影响
(2)海水。海水中含大量EaCl为主的盐类,常将海水近似地看做是含w(EaCl)=3%或3.5%的溶液。海水成分见表10-7,人造海水成分见表10-8。海水腐蚀主要是溶解氧的作用。海水中溶解氧量见表10-9。
表10-7 海水的主要成分

表10-8 人造海水的化学成分

注:w(Cl)=19.38%×10-3;用0.1mol/L的EaOH将pH值调至8.2。
表10-9 标准大气压及饱和状态下海水中溶解氧量(10-4%)(https://www.xing528.com)

5.流速的影响 金属在淡水中随流速增加,氧的浓度梯度增大,使扩散速度增大,加速腐蚀,如图10-10所示。当流速增大到一定程度时,表面产生钝化,又降低腐蚀速度。流速再增加时,由于机械作用,钝化膜被破坏,又加速腐蚀。在海水中情况有所不同,碳钢等不易产生钝化膜的金属,随流速增加腐蚀程度增大;易钝化金属与在淡水中的情况相似。
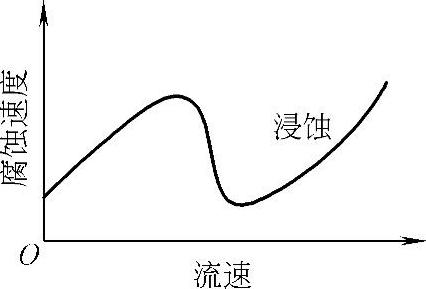
图10-10 流速对腐蚀的影响
10.1.4.2 材料及热处理与腐蚀的关系
1.纯金属的耐蚀性
(1)纯金属的耐蚀性决定于三个因素,一是热力学稳定性,标准电极电位较正者耐蚀性好,较负者耐蚀性差;二是在热力学不稳定的金属中钝化能力强的(例如Ti、Eb、Al、Cr、Be、Ei、Co、Fe等)在氧化性介质中容易钝化,提高耐蚀性,而在还原性介质中不耐蚀;三是在热力学不稳定的金属中,当腐蚀初期形成致密的腐蚀产物时也可提高耐蚀性,例如Pb在H2SO4中,铁在磷酸中等。
(2)金属元素的耐蚀性在周期表中也是有规律的,特别是在固定腐蚀介质中时,其规律更明显。元素周期表中,从上向下,元素的热力学稳定性增大;易钝化的金属元素一般存在于Ⅳ~Ⅷ族的左侧;活性和较活性元素在第Ⅰ、Ⅱ族中。
元素周期表中一些金属的近似耐蚀性如图10-11所示。
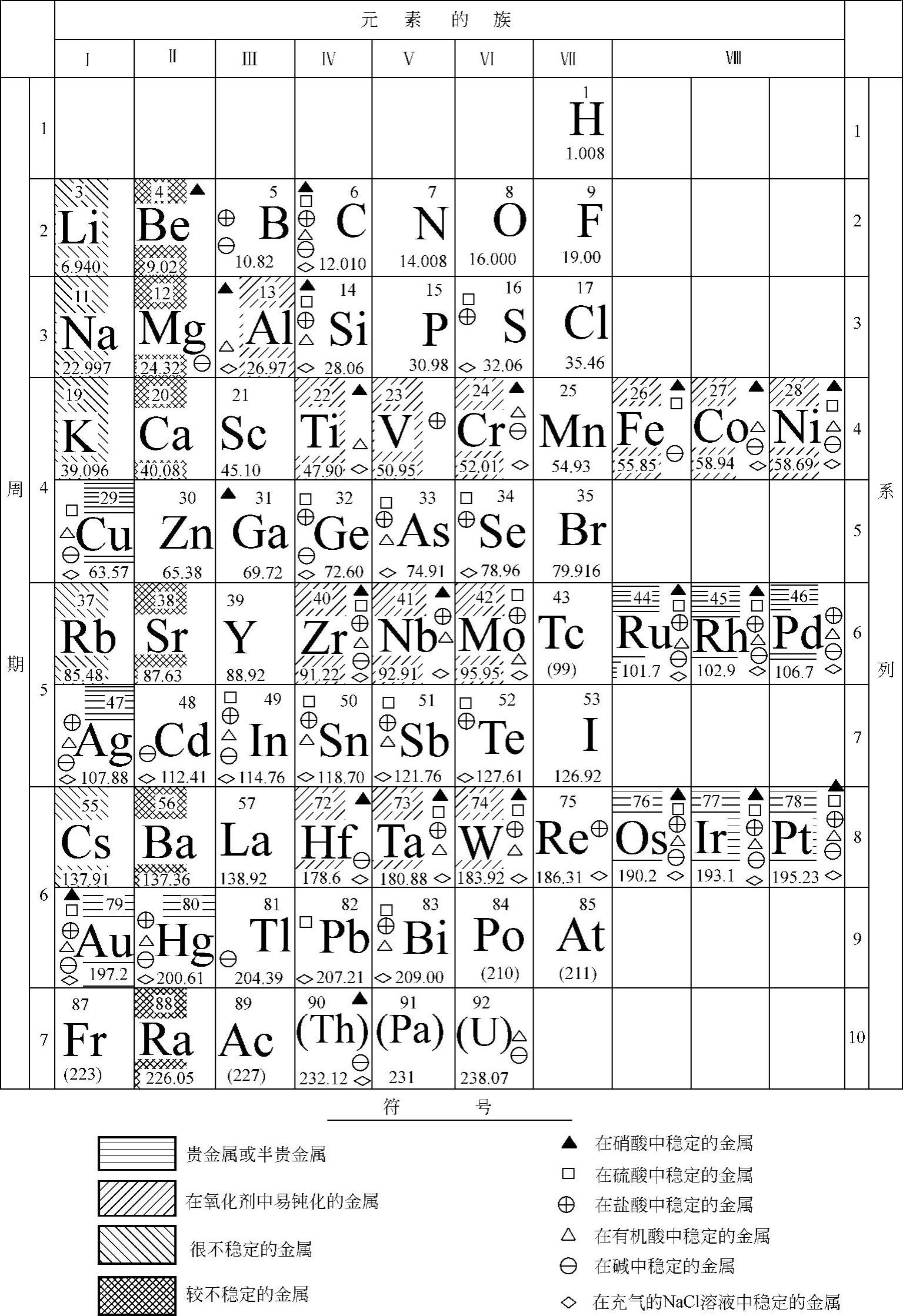
图10-11 周期表中某些金属的近似耐蚀性 (所引用数据是对于室温下中等或较高浓度的酸或碱)
2.合金的耐蚀性 合金耐蚀性很复杂,既取决于材料的化学成分、组织结构,又与腐蚀介质等外界因素有关。提高热力学稳定性的元素可提高合金的耐蚀性。在动力学方面则与腐蚀过程控制因素有关系,例如,当腐蚀过程主要受阴极控制时,用合金化方法阻滞阴极过程能显著提高耐蚀性。纯金属中的杂质、合金中第二相多数是阴极相,如果减少这些阴极相数量,可提高耐蚀性。例如经固溶处理的硬铝比退火或时效状态耐蚀性好。
通过合金化提高合金钝化能力,是增强材料耐蚀性的有效途径之一,也可用减少合金中的阳极面积,提高阴极效率,使合金的腐蚀电位向钝化区移动。
(1)化学成分的影响。合金耐蚀性复杂,以常用的碳钢及低合金钢为例,碳钢耐蚀性与碳含量有关系,也与介质性质有关。在酸性溶液中,碳含量对材料耐蚀性有影响,而在中性溶液中碳含量的影响不明显。在非氧化性酸中,随碳含量增加,碳钢腐蚀速度增大,如图10-12所示。在氧化性酸中,随碳含量增加,开始时腐蚀速度增大,碳含量达到一定值后,腐蚀速度下降,如图10-13所示。在大气、淡水、海水、中性或弱酸性水溶液中,碳含量对碳钢腐蚀速度影响不大。
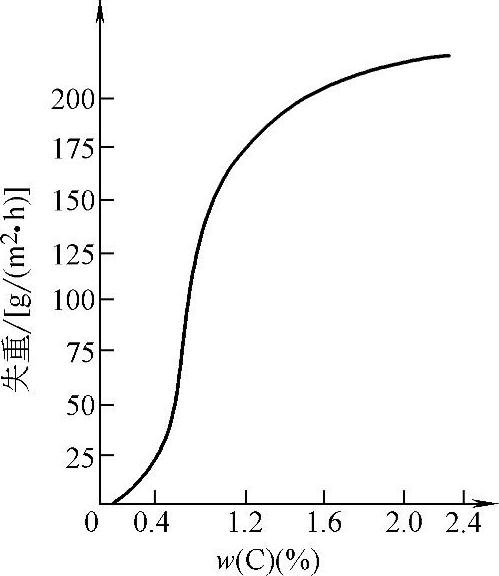
图10-12 在含20%(质量分数)的硫酸溶液中碳钢的腐蚀速度与碳含量的关系(25℃)
钢中的硫对耐蚀性有影响,在酸性溶液中促使材料加速腐蚀。
碳钢不耐蚀,低合金钢稍好。低合金钢中的合金元素以固溶状态存在时,对材料耐蚀性影响不大;以碳化物存在时对耐蚀性有影响。在不同使用条件下,材料的耐蚀性各异,例如含P、Cu、Cr等元素时可提高耐大气腐蚀能力。耐H2S应力腐蚀的钢有:12AlMoV、12CrMoAlV、12Cr2MoAlV、40MnMoEb等。
(2)热处理的影响。消除应力、使组织均匀化的热处理可提高材料的耐蚀性。碳钢淬火后回火温度与耐蚀性的关系如图10-14所示。显然,中温回火时的耐蚀性最低。如果碳含量相同,片状珠光体比粒状珠光体耐蚀性差。珠光体弥散程度越大,越不耐蚀。
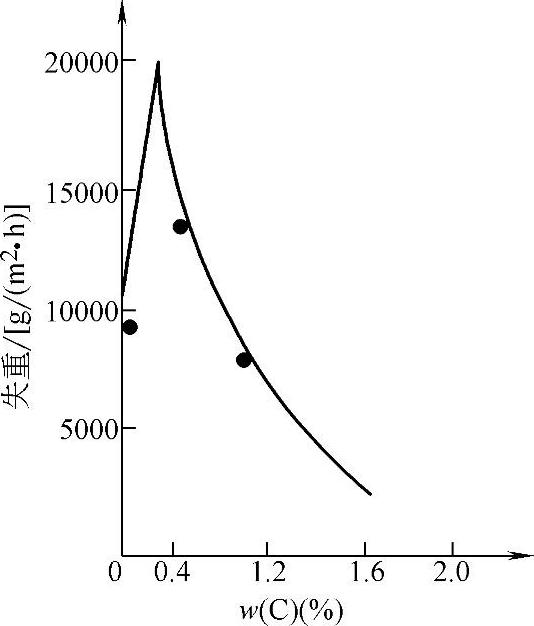
图10-13 在含30%(质量分数)的硝酸溶液中铁碳合金的腐蚀速度与碳含量关系

图10-14 碳钢回火温度对在0.1mol/L的硫酸溶液中腐蚀速度的影响
10.1.4.3 应力作用
材料中存在应力才会发生变形和断裂。在腐蚀环境介质中,应力加剧了材料的破损。材料中的应力一是来源于外加载荷;二是材料在加工制作过程中产生的残余内应力;三是材料中的腐蚀产生物。例如阴极反应产生的氢进入金属中,并在某些地方富集,形成氢分子(H2),其压力很大,可能出现氢致开裂。图10-15所示为纯Fe冷变形程度(扭转次数)与腐蚀速度的关系。

图10-15 在H2SO4溶液中纯Fe的冷变形程度(扭转次数)与腐蚀速度的关系
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




