10.1.3.1 特性
金属在电解液中的腐蚀是电化学腐蚀。电化学腐蚀与原电池原理相同,被腐蚀的金属是阳极,失去电子后成为正离子,进入电解液中(ne·Mn+→Mn++ne)。例如Fe被腐蚀时成为Fe2+,进入电解液,产生的两个电子经导线流到阴极端,阴极借助于电解液中带正电荷的H+与电子进行反应,使系统达到平衡,将氢还原成原子(H++e→H),氢原子可能进入金属中使材料产生氢脆,也可能形成氢分子(H2),在阴极上产生气泡释出。
根据电池的电极大小可分为宏观电池与微观电池。金属腐蚀时,由于化学成分和组织不均匀、表面不平整、表面膜不完整等的微电池作用不能忽视。
10.1.3.2 电极电位
将一块金属片置于电解液中产生电荷转移,这个体系称为电极。例如丹尼尔电池中的Cu片与Zn片在CuSO4或ZnSO4溶液中构成了Cu极与Zn极。由于两个电极的电位不同,用导线连接后有电流流动,所以电极电位就是金属(导体)与电解液(离子导体)间的电位差。
Eernst计算了双电层上达到平衡状态时的电极电位(E),如下式:
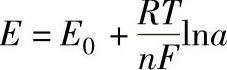
式中 E0——金属的标准电极电位;
R——气体常数;
T——热力学温度;
F——法拉第常数;
n——参与反应的电子数;
a——金属离子浓度。
无论是平衡电极电位还是非平衡电极电位的绝对值均无法测定。目前是人为规定氢电极电位为零,将待测的金属与氢电极组成原电池,此电池的电位就是待测金属的电极电位。因为用氢标准电极测定电位很不方便,通常采用参比电极测定金属电位。一些参比电极的电位见表10-3。
表10-3 常用参比电极的电位值

①各电极的电极电位值系指25℃时相对于SHE的电位值。
②温度系数是指每变化1℃时电极电位变化的数值。
将参比电极测定的电位值加上氢标准电极电位(0.36V),便是该金属的氢电位数值。
表10-4是常见金属25℃时的标准电极电位。表中金属的电极电位(E0)比氢越高(越正),越不易受腐蚀,这类金属属贵金属。比氢标准电极电位越低(越负)时,越易受腐蚀。
表10-4 金属在25℃时的标准电极电位 (对于Me⇋Men++ne的电极反应)

10.1.3.3 极化与极化曲线
将两块不同的金属置于同一电解液中,两个电极的电位差就是腐蚀的原动力。然而此电位差是不稳定的,当腐蚀原电池接成回路,有电流流过时,将引起电极电位的变化,这种现象称为电极极化。通阳极电流时阳极电位向正的方向变化,是阳极极化;通阴极电流时阴极电位向负方向变化,是阴极极化。无论阳极极化或阴极极化,都使两极间电位差减小,从而导致腐蚀电流减小。因此极化作用是阻滞金属腐蚀的重要因素,并能减缓金属的腐蚀速度。
表示电极电位和电流间关系的曲线是极化曲线。阳极电位与电流间关系曲线为阳极极化曲线,阴极电位与电流间关系曲线为阴极极化曲线。它们可借助参比电极用实验方法来测定。(https://www.xing528.com)
艾文思(Evans)将极化曲线简化成图10-1所示的示意图,图中E°阴S是阴极极化曲线,E°阴点是局部阴极反应的平衡电位。E°阳S是阳极极化曲线,E°阳点是局部阳极反应的平衡电位。曲线的斜率表示极化率。
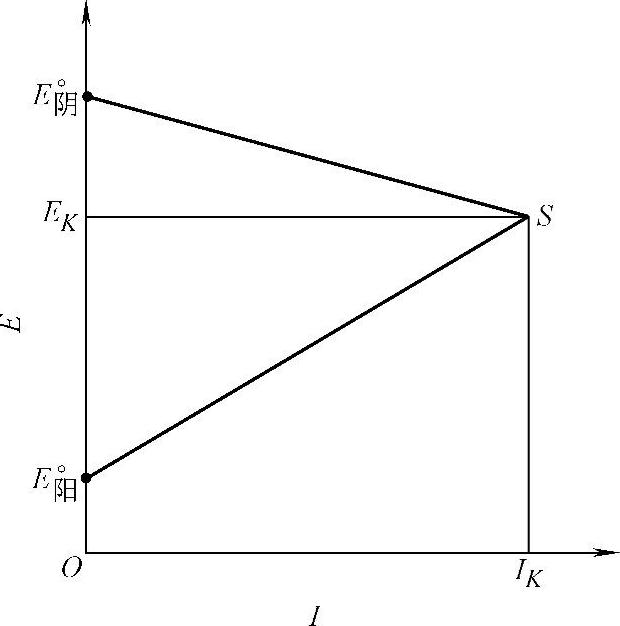
图10-1 艾文思极化曲线
当其他条件相同时,局部阴极极化或局部阳极极化越小,即极化曲线斜率越小,则腐蚀电流越大,腐蚀越快,如图10-2a所示,IK2>IK1。
如果极化率相同,则腐蚀初始电位差越大,腐蚀电流也越大,如图10-2b所示,IK3>IK2>IK1。

图10-2 几种腐蚀极化曲线示意图
10.1.3.4 钝化
一些较活泼的金属,在特定的环境中,例如铁在浓硝酸中,表面形成一层极薄的钝化膜,使金属由活化状态变成钝态,这种现象称为钝化。金属钝化时出现电极电位向贵金属方向移动,例如Fe的腐蚀电位从-0.5~+0.5V升至+0.5~+1.0V;Cr的电位从-0.6~+0.4V升至+0.8~+1.0V,几乎接近贵金属电位。
钝化现象很复杂,至今无一致的定义。但是金属钝化时阳极行为具有共同特征,这点是清楚的。典型的具有钝化特征的金属阳极极化曲线如图10-3所示。从曲线走向可以看到,在活化溶解阶段随电位增加,腐蚀电流增大,当电位达到Epp时,再增加电位时电流反而减小,此时已进入钝化状态。当电流减小到Ip时,再增加电位,电流不再变化,此时金属已处于完全钝化状态。当电位高于一定值后,电流密度再次随电位升高而增大,此时已进入过钝化阶段。
10.1.3.5 金属腐蚀图(E-pH图)
借助于热力学建立的金属腐蚀电位(E)与pH值关系的电化学平衡图称为金属腐蚀图。这个图的创始人是比利时学者M.Pourbaix,因此也称为Pour-baix图。这种平衡图与合金相图相似,表示在某一电位和pH值时的体系稳定状态。从该图可以判断金属在平衡状态下发生腐蚀的倾向和可以采用的防护措施。
腐蚀图的应用有一定局限性,因为金属腐蚀很少是在平衡状态下进行的,并且实际腐蚀情况远比该图所表示的复杂得多。图10-4所示为25℃时Fe-H2O系腐蚀图,图10-4a所示是固相物质为Fe、Fe3O4、Fe2O3;图10-4b所示是固相物质为Fe、Fe(OH)2、Fe(OH)3。图10-4a中各条曲线的意义见表10-5。

图10-3 有阳极钝化的理想阴、阳极极化曲线
注:电流密度I的单位是mA/m2。
表10-5 Fe-H2O系腐蚀图中各条曲线的意义

(续)

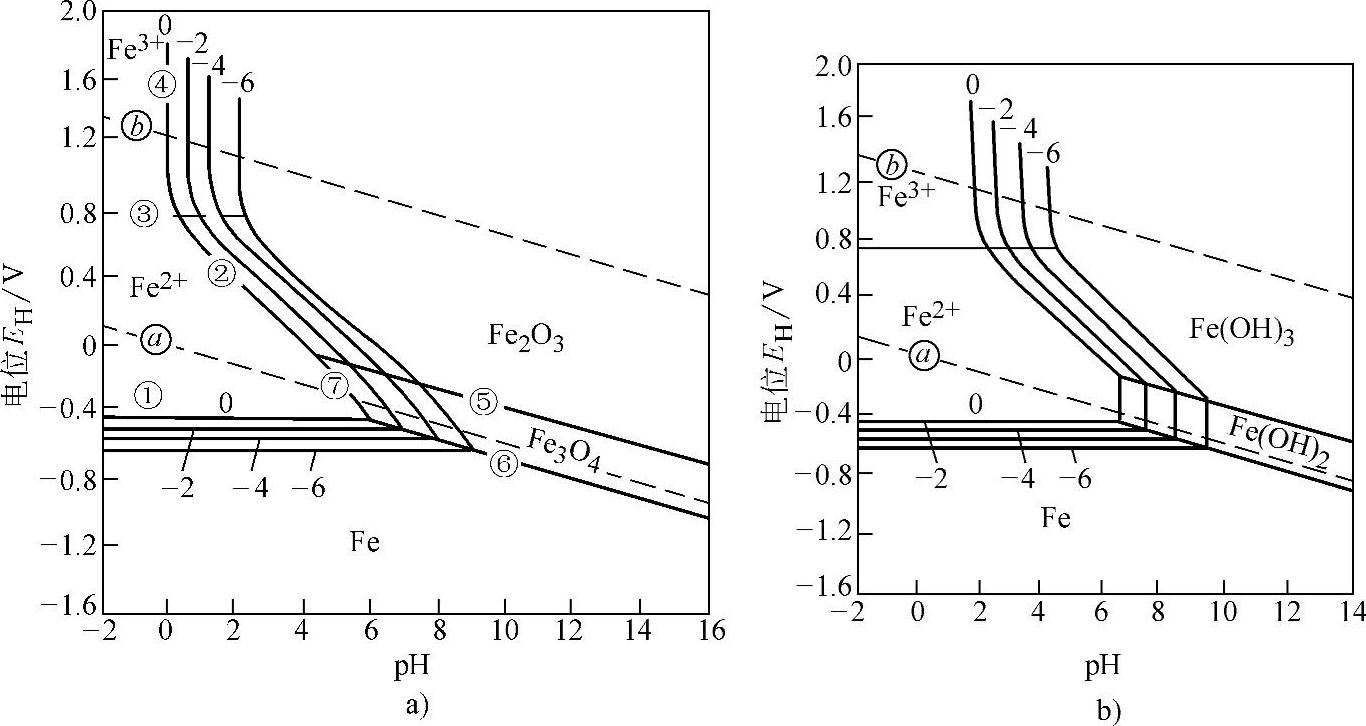
图10-4 Fe-H2O系腐蚀图
a)考虑固相物质为Fe、Fe3O4、Fe2O3,25℃b)考虑固相物质是Fe、Fe(OH)2、Fe(OH)3,25℃
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




