镉离子的电化学电位出现在较低的电位区间,一般在汞电极表面能得到很好的阴极还原峰,而在普通的固体电极表面电化学响应较差。溶出分析是在固体电极表面检测镉的一种好的方法[244-246]。易洪潮等[244]用离子交换伏安法同时测定水中的镉、汞。该法在磷酸盐缓冲溶液中,镉、汞在钠型蒙脱石修饰玻碳电极上通过离子交换富集,获得一个灵敏的阳极溶出峰,可同时测定痕量的镉、汞离子。Soares等[245-246]用微分脉冲阳极溶出伏安法等电分析技术对镉在有吗啉环N-取代氨基酸存在的缓冲溶液中的电化学行为进行了研究,并研究了N-取代基氨基磺酸胡椒丫嗪环缓冲溶液在重金属形态研究过程中的影响。在本实验中,我们也发现在玻碳电极表面的负电位溶出过程对检测题中的壳聚糖镉配合物具有重要影响。
图5.2.2为配合物CHTCd在-1.3V条件下电解不同时间于玻碳电极表面得到的循环伏安图。由图可知,随着电解时间的延长,得到的氧化还原峰电流逐渐增大,表明更多的电化学活性配合物在电极表面发生了氧化还原,据此我们推测配合物在电极表面也发生了溶出过程。我们将溶出时间(即电极在配合物溶液中的电解时间te)对氧化峰电流Ipa作图,结果发现,当溶出时间达到100s时,峰电流Ipa不再随富集时间变化而变化,即表明配合物在该富集时间下在电极表面的溶出已达到饱和。

图5.2.2 CHTCd在-1.3 V下电解不同时间(te)的循环伏安图
在整个富集过程中,考察氧化峰和还原峰的峰电流比值(Ipa/Ipc)和峰电位差ΔEp与富集时间te的关系发现,随着富集时间的延长,Ipa/Ipc由0.9逐渐增大至1.5,ΔEp也由0.15V增大到了0.18V(图5.2.3),表明配合物在电极表面的电化学反应可逆性随着富集时间的延长不断降低。
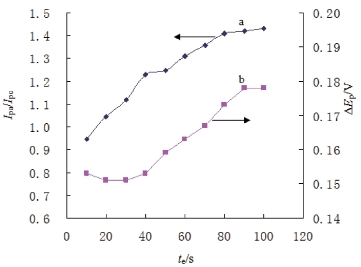
图5.2.3 CHTCd的氧化还原峰电流比Ipa/Ipc(a),峰电位差ΔEp(b)与电解时间te关系曲线

图5.2.4 CHTCd在不同电位Ee下电解100 s的循环伏安图
另外,考察了相同的电解时间下,电解电位(Ee)对配合物在电极表面电化学响应的影响,结果如图5.2.4所示。当Eacc在-0.9 V时,配合物在电极表面上只能得到较小的氧化还原峰,而当富集电位达到-1.0 V时,配合物的氧化还原峰电流均出现了明显的增大,表明有了更多的配合物在电极表面发生了还原反应,而且在更低的富集电位下,除了对氧化峰的峰电位(Epa)有一定的影响外,氧化还原峰电流和还原峰电位几乎不随富集电位的变化而变化,表明在较低电位下,富集电位对配合物的电化学响应影响不大。
根据图5.2.2和图5.2.4,我们发现在任一电解时间和电解电位下,配合物的氧化峰和还原峰电位之差ΔEp都大于0.15 V,表明实验中的配合物CHTCd在玻碳电极表面的电化学行为为一不可逆的电化学过程,因此,根据以下公式5-1[179]可以求得CHTCd在电极上氧化的电子转移数(n)。
|Ep-Ep/2|=1.857RT/(1-α)nF (5-1)
公式中,R为气体常数,J/(mol/K);T为绝对温度,K;α为电子转移系数,F为法拉第常数,C/mol。
由图5.2.4a得到|Ep-Ep/2|=50 mV,代入公式中求得(1-α)n=0.99,根据文献取α=0.5(一般,0.3<α<0.8),得n=1.98 ≈ 2,即在本实验条件下,CHTCd的氧化为2e电极反应过程。
基于以上电化学响应,推测标题配合物在电极表面发生了如下的电化学过程:(https://www.xing528.com)
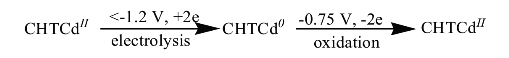
如果上述推测成立的话,则当改变电解富集时间时,配合物的电化学行为可可能受不同的过程控制。为了验证此结论,分别将富集时间固定为10 s和饱和富集时间的100 s,然后在0.02 V/s-0.50 V/s范围内改变扫速,观察配合物电化学行为的变化,结果发现随着扫描速率的变化,配合物在电极表面的电化学曲线呈有规律的变化。将得到的氧化峰电流Ipa对扫速v或扫速的平方根v1/2作图,结果如图5.2.5所示。当富集时间较短时(10s),配合物的氧化峰电流Ipa与v1/2呈良好的线性关系(图5.2.5A曲线b),Ipa/μA=5.77v1/2/(V/s)1/2-0.0067,γ=0.999,而与v呈一条向下弯曲的曲线(图5.2.5A曲线a),这一结果表明,在该电解时间下,配合物的电化学行为主要受配合物在本体溶液中扩散过程控制[186]。而当固定电解时间为100 s,在相同的扫速范围内将得到的氧化峰峰电流Ipa对扫速v或扫速的平方根v1/2作图,发现Ipa与v则呈良好的线性关系(图5.2.5B曲线a),Ipa/μA=20.78v/(V/s)+0.4111,γ=0.998,而与v1/2则呈一条向上弯曲的曲线(图5.2.5B曲线b),说明配合物在电极表面的电化学行为由原来的受扩散控制转变为了受吸附控制[186]。
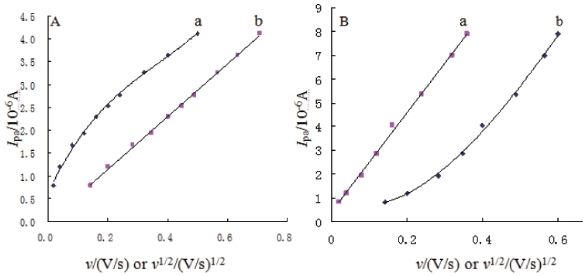
图5.2.5 CHTCd在-1.3 V下电解10 s(A)和100 s(B)后氧化峰电流Ipa与扫速v(a)或扫速平方根v1/2(b)的关系曲线
结果表明,在较短的富集时间下,因为配合物的分子量较大,在本体溶液中的扩散速度较慢,其电化学行为主要扩散控制;而当增长配合物在电极表面的富集过程,配合物在电极表面经历较长时间的电极溶出,导致配合物的整个电化学过程受吸附控制。
对于受吸附控制的不可逆过程,通过考察扫速与峰电位的关系可计算电活性分子发生电化学反应的电化学常数。
图5.2.6为氧化峰电位Ep与扫速ν的关系曲线,将Ep沿Ep-ν变化趋势向纵坐标延伸交得到配合物电化学反应的式量电位E0=-0.772 V。然后,将峰电位Ep对扫速对数lnν作图,得到一条直线,如图5.2.7,关系曲线为Ep=0.0261ln[ν/(V/s)]-0.6784,γ=0.9986符合Laviron公式[204]:

经计算得到配合物的(1-α)n=0.98,该结果与上述通过半峰电位公式6-1计算得到的结论一致。
将E0和直线斜率代回Laviron公式,根据Ep-ln ν直线关系的截距,可计算得到该配合物在电极表面氧化的电子转移速率Ks为1.4×103s-1。(如图5.27)
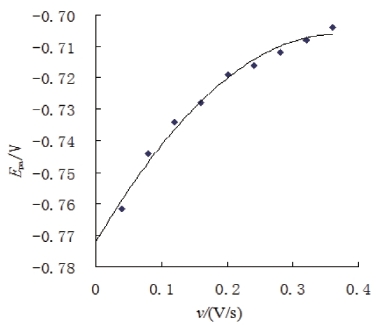
图5.2.6 CHTCd在-13 V下电解100 s后氧化峰电位Epa与扫速v的关系曲线

图5.2.7 CHTCd在-1.3 V下电解100 s后氧化峰电位Epa与扫速对数ln v的关系曲线
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




