在进行无菌医疗器械包装性能确认时应确定关键过程参数,包括范围和公差,必须在所有预期的生产条件下保证产品满足规定的要求,这些关键过程参数应采用有效的统计技术来确定。可用的统计技术工具包括:故障模式和效应分析(FMEA)、实验设计(DOE)、热封曲线分析、视觉属性。
1.故障模式和效应分析(FMEA)
以托盘的成型和封盖举例说明故障模式和效应分析是研究故障的系统方法,可以用于产品的设计开发和过程控制,也可以用来确定故障模式的严重度和概率。采用FMEA可以确定潜在故障模式的严重度和概率,这些潜在故障模式通常是通过以往相似产品或过程的经验而识别的。在这种情况下(产品设计开发),FMEA可用于为制造、装载、密封和包装过程的设备建立过程参数。其程序涉及以下几个阶段:
(1)识别导致产品拒收(失效模式)的缺陷。
(2)确定失效模式的原因和其发生的概率。
(3)确定失效模式的结果。
(4)为严重度、发生概率和每个失效模式的探测度进行分级。
(5)识别现有控制措施和探测失效的概率。
(6)使用表5-1计算每个失效模式的风险优先数(RPN)。
RPN=严重度×概率×探测度
表5-1 失效模式和效应的分析
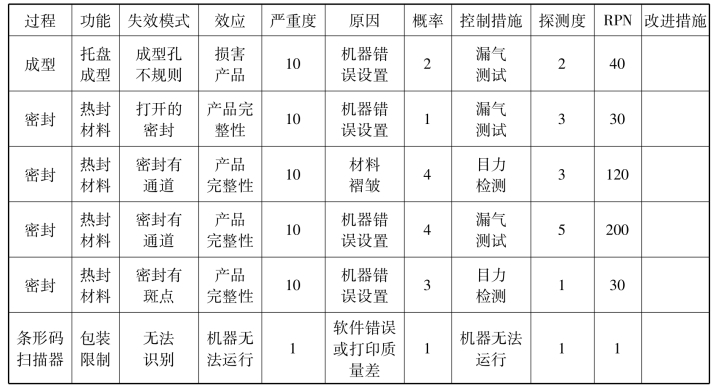
(7)降低RPN的措施。
2.实验设计(DOE)
实验设计是用于确定最优过程参数的过程,即得到能保证连续生产良好质量的产品的过程条件。在该阶段获得的信息越多,过程控制就越容易。托盘的成型和后续的盖子的热封要求对温度、压强和保压时间进行考虑。在这两种情况下,都必须找到对无菌屏障系统影响最小的过程条件的范围。例如,在密封盖子时,过程条件必须保证可接收的密封强度,应有良好的密封质量,且密封强度波动应最小。
从简单的线性筛选到确定不同参数对密封结果的相关效应,再到复杂的部分因子二次研究,可以进行多个实验。通常先进行一个简单、线性的实验确定参数的显著性,然后再使用中间点进行更加复杂的研究,来保证密封过程与数据吻合的良好的过程数学模型。正常情况下,温度是最重要的变量,其次是时间,最后是压强,压强在较大范围内没有显著影响。
关于实验设计(DOE)有很多专业的论述,可以参考相关科学文献。实验设计(DOE)是一种在性能确认(PQ)过程中被广泛采用的试验方案的设计工具,对于多个参数可导致同一结果的试验或需要测试多个变化水平对同一结果产生影响的试验使用这一工具可以减少试验次数,否则试验工作将消耗大量的时间和材料成本。
用于为包装热封过程建立最优条件的设计工具还有:热封曲线分析、密封区域的目力评估、密封区域的目力评估和热封曲线分析的组合、过程能力的确定、密封完整性、密封质量(目力评估)。
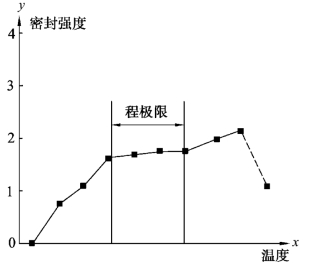
图5-18 最优过程参数的热封曲线
3.热封曲线分析(过程范围评估)
热封曲线分析是温度、压强和保压时间的矩阵如何影响密封强度的评价,可以通过构建曲线来确定多个参数的影响,一般认为压强和保压时间对密封质量的影响较小。因此,在温度波动时,压强和保压时间作为恒定的参数,通过在某一范围内密封强度满足规范要求建立过程极限。当密封强度超出过程极限时,无菌屏障系统应仍然能保持包装完整性,但密封已能显示出可见的缺陷,如图5-18所示。
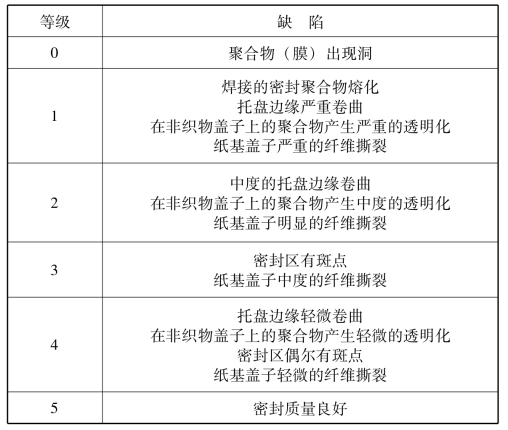
4.密封的目力打分评价(https://www.xing528.com)
将密封按照在过程范围两侧的缺陷进行分级,高分表示良好的质量,如表5-2、表5-3所示。
表5-2 密封范围下限

表5-3 密封范围上限
5.热封曲线分析和目力打分结合
热封分析的结果可以与目力打分法结合并生成,如图5-19所示。
6.过程能力的确定
确定过程能力的目的是表明过程在统计学控制下可以连续生产满足规定要求的产品。最科学的方法是计算过程能力Cp/Cpk。
当过程均值无偏移时,按以下公式计算:
![]()
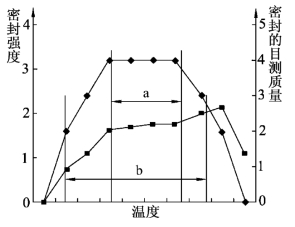
图5-19 密封强度、目测质量与温度的关系
a.推荐的过程极限;b.推荐的规定极限
其中,σ为样本标准差,USL为规范上限,LSL为规范下限。
当过程均值有偏移时,按以下公式计算:
![]()
其中,CSL为最接近均值的规范极限,![]() 为过程均值。
为过程均值。
Cp/Cpk值的指导原则见表4-17。
如何使Cp/Cpk最大化,有两个基本条件:一是保持符合规范的合理的波动范围尽可能最大,二是取得最小的波动率。换言之,即在这些范围内密封的完整性应得到保证,且包装应可以承受灭菌过程和抵抗运输、分配和存储过程中的损害。鉴于这些原因,正确理解特定材料和密封设备的过程验证是至关重要的。
如果进行研究后仍然无法达到所需最小的Cpk,应进行过程分析,查明造成超范围波动的主要根源。通常可以从材料厚度波动、温度偏差、密封表面的平整度和超出波动范围的温度控制器等方面进行检查。
在进入正式确认活动前,应为过程准备稳定的样本,可采用多批次材料,这样可以充分地代表所预期的波动。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




