1.材料老化验证和无菌有效期的验证
包装材料或预成型无菌屏障系统的生产商应提供产品的有效期,以及确定有效期的加速老化试验报告。根据ISO 11607-1标准的要求,实时老化试验和加速老化试验宜同时进行,使用单位可向包装材料生产商索取老化试验报告。产品有效期的验证过程是产品诸多性能在加速老化试验和实时老化试验前后的比对,比对的性能应至少包括微生物屏障性能、封口强度、完好性、力学性能等。老化前后各项性能数值应在标准规定的范围内,其差值最好不大于15%(仅供参考)。产品有效期是指该产品可以使用的期限,与无菌有效期是两个概念。产品有效期由器械制造商提供且负全责。灭菌后的无菌有效期除和材料的自身性能有关外,还与包装系统的封口、包装形式、包装大小、运输存储密切相关,特别是运输存储环境的重要性甚至大于材料本身性能。因此,对于灭菌后的无菌有效期,应在包装材料生产商提供的验证报告基础上进行包装完整性验证和包装稳定性验证确定,并形成文件。
加速老化试验标准为ASTM F1980,已转化为医疗器械行业标准YY/T 0681.1。
×××材料加速老化与实时老化试验结果如表3-12、表3-13所示。
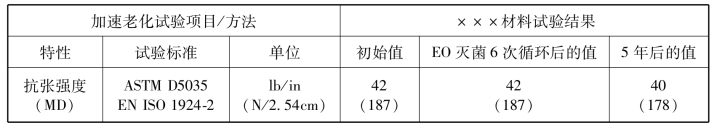
表3-12 ×××材料加速老化试验结果
 (https://www.xing528.com)
(https://www.xing528.com)
表3-13 ×××材料实时老化试验结果
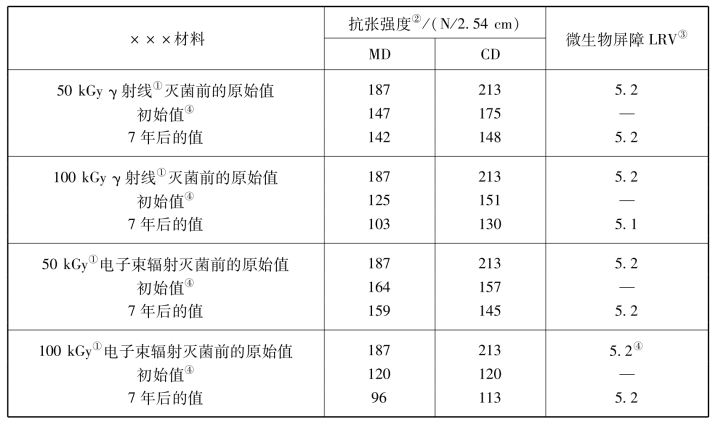
注:①50 kGy为单次剂量。100 kGy为累计量,表示50 kGy的加倍剂量。
②ASTM D5035和EN ISO 1924-2;根据速度和计量长度进行修改。
③根据ASTM F1608标准对数下降值(LRV)进行检测。
④初始值是灭菌后、老化试验开始时的数值。
2.加速老化必须和实时老化同时进行
加速老化验证可使产品快速上市,但制造商必须同时做实时老化试验。待自然放置的样品达到规定的有效期时,进行各种性能试验,从而最终确定产品的有效期。放置过程中最好选取有代表性的时间节点进行测试,若只做最终时间的测试,验证过程的风险是非常高的。
值得关注的是,灭菌前的材料寿命不能涵盖灭菌后的材料寿命,也就是说,灭菌前5年有效期不能等同于灭菌前2年加灭菌后3年的材料有效期。应考虑材料在正常使用中可能发生的变化,分别确定灭菌前和灭菌后的有效期。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




