对预期灭菌过程的适应性要求分为两种情况:一种是根据预期使用的灭菌方式来决定将要使用的包装材料或预成型无菌屏障系统;另一种则相反,根据预期使用的包装材料或预成型无菌屏障系统来决定将要采用的灭菌方式。这两种情况在实际工作中都有可能出现。第一种情况较为常见,如医院要根据现有的灭菌器选择合适的包装材料或预成型无菌屏障系统。第二种情况是出于节约成本或方便采购考虑,或是为了应对供应不及时等情况,或是因为一次性无菌产品超过了无菌有效期,或是为了满足一般无菌产品在关键场合的使用要求。
1.材料不能对灭菌过程产生不良影响(材料不能影响灭菌效果)
(1)对于包装材料供应商来说,应证实材料和预成型无菌屏障系统适宜预期使用的灭菌过程和循环参数。对无菌屏障系统和(或)包装系统来说,包装材料承受灭菌过程和保持结构完整性的能力则是关键的要求。同时,包装材料不能对灭菌效果产生影响。如环氧乙烷、湿热或其他气体灭菌过程要求去除空气,使灭菌剂穿透无菌屏障系统和(或)包装系统。气体灭菌要求高温高湿的条件,所选的材料必须与此相容。应评价气体灭菌对无菌屏障系统带来压强变化的挑战。因此,要求无菌屏障系统和(或)包装系统具有耐受性和充分的透气区域,并且在所有附加层中有充足的空间使无菌屏障系统膨胀。
(2)对于无菌医疗器械灭菌过程而言,包装材料适应灭菌过程的确认可与所采用的灭菌过程的确认同步进行。包装验证同灭菌过程验证同步进行,可以确保灭菌效果的有效性。
2.灭菌过程不能对材料产生影响(材料必须能耐受灭菌过程)
包装材料供应商应评价材料的性能,以确保在经受规定的灭菌过程后材料的性能保持在规定的限度范围。理论上要对材料所有性能进行灭菌前后的数值比对,这是一项非常庞大的工作。为了减少工作量,通常可以在材料灭菌后对材料性能进行验证。
对灭菌前后指标变化范围的限度暂无标准要求,通常以最小值应满足现有规范的限量值为准。如果没有限量值要求,以灭菌前后差值不大于15%为宜(仅供参考)。若有规定值,则应确认是否都在规定范围内。
就灭菌方式对材料性能的潜在影响而言,环氧乙烷灭菌对包装材料的性能影响很小,其他如辐射灭菌和等离子气体灭菌对材料的属性可能带来影响,参见AAMI TIR17标准。辐射灭菌对高分子材料的影响巨大,高压蒸汽灭菌对材料的影响也很大,特别是透气性纤维材料的微生物屏障性能在灭菌后会有所下降,应关注供应商提供的有关报告。低温甲醛灭菌对材料的要求基本上等同于蒸汽灭菌,但由于甲醛气体的穿透能力较差,在选用包装材料前,最好做挑战性检测。低温甲醛蒸汽灭菌器随机配套的Process Challenge Device(PCD)就是做挑战性试验用的(PCD检测随低温甲醛蒸汽灭菌器而诞生,对低温甲醛蒸汽灭菌验证的意义远大于对普通蒸汽灭菌的验证)。含天然纤维的包装材料不能用于过氧化氢等离子灭菌,因分子中较强的诱导力会产生一些正电和负电基团,从而吸收带电的等离子,降低灭菌的效果,如纸张、纸质胶带、纸质的指示卡等。
对于预成型无菌屏障系统和无菌屏障系统的灭菌相容性除考虑以上因素外,还应考虑灭菌过程对包装完好性的影响。如封口强度灭菌前后的对比,要考虑生物相容性的要求、环氧乙烷残留的要求等。表3-6、表3-7、表3-8、表3-9分别列出了各种灭菌方法灭菌前后某聚烯烃无纺布的强度和屏障特性。
表3-6 环氧乙烷(EO)灭菌前后的强度和屏障特性
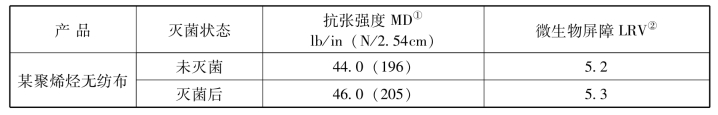
注:①按照ASTM D5035、EN ISO 1924-2。
②按照ASTM F1608测试的对数下降值(LRV)。
表3-7 包装产品经各种剂量①辐射前后的强度和微生物屏障特性试验结果
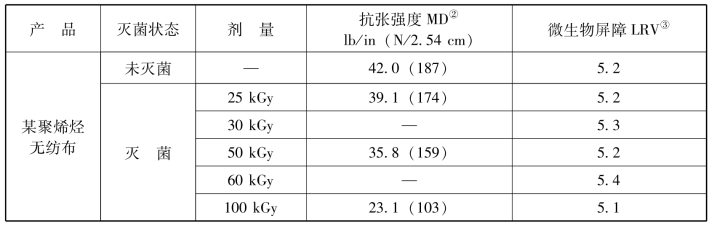
注:①25 kGy和30 kGy为单次剂量;其他为加倍剂量的累计量,即50 kGy代表25 kGy的加倍剂量。
②按照ASTM D5035和EN ISO 1924-2。
③按照ASTM F1608测试的对数下降值(LRV)。
表3-8 包装产品经各种剂量电子束辐射前后的强度和微生物屏障特性试验结果
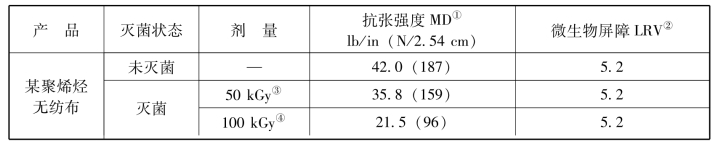
注:①按照ASTM D5035和EN ISO 1924-2。
②按照ASTM F1608测试的对数下降值(LRV)。
③50 kGy为单次剂量。
④100 kGy为累计剂量,代表50 kGy的加倍剂量。
表3-9 包装产品蒸汽灭菌前后的物理性质试验结果
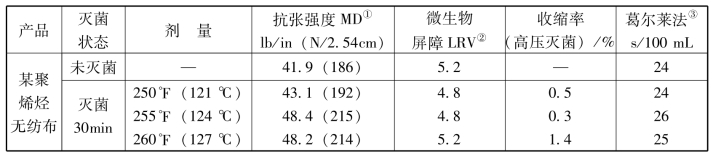
注:①按照ASTM D5035和EN ISO 1924-2。
②按照ASTM F1608测试的对数下降值(LRV)。
③按照TAPPIT460和ISO 5636-5。(https://www.xing528.com)
3.灭菌相容性的实验方法
灭菌适应性的确定应使用参照有关国际标准或欧洲标准设计、生产和运行的灭菌器。作为选择灭菌过程的一部分,确认医疗器械最终无菌屏障系统所需的预期灭菌批数和类型是重要的因素。
目前,ISO 17665-1、ISO 11135、ISO 11137、ISO 14937、EN 285、EN 550、EN 552、EN 554、EN 1422、EN 14180标准之间正处于协调中。使用的各种灭菌器(灭菌方式包括医院用的环氧乙烷、高温蒸汽、低温甲醛、过氧化氢、等离子灭菌等)应当在基于各种相关标准的基础上设计制造,才能保证灭菌过程验证的科学性和有效性,从而确保产品灭菌过程的安全有效。由于我国灭菌器标准尚不完善,若使用国产灭菌器进行验证则必须确认其符合相关的国际标准。具体试验方法参见EN 868-5标准的附录A。
(1)试样的制备:取10个供试品(组合袋或卷材长度),各装入一半未压紧的脱脂棉纱布(参见YY 0331标准)。
(2)步骤:按制造商的推荐用适宜的密封器密封试验样品。将试样放在灭菌器中,将运行循环调至包装材料生产商规定的极限。应在灭菌器制造商规定的极限对灭菌器提供蒸汽、空气、水等,进行运行循环后取出试样并进行目力检验。
注:灭菌器标准参见YY 0503、YY 1007、EN 285、EN 1422和EN 14180等。灭菌剂的通用要求和医疗器械一般灭菌过程的开发、确认和常规控制见ISO 14937。
(3)试验报告:报告塑料结合层分离或发白的数量。
4.灭菌相容性的验证和老化验证的关系
对预期用途适应性的确定应考虑材料在常规供应中发生的变化。材料在保存过程中性质的变化不应对灭菌效果产生影响,老化验证中应考虑与灭菌过程的相容性。
有的材料需要在灭菌前或灭菌后保存很长时间,或包装好的医疗器械非无菌提供,使用前由医疗机构灭菌后直接使用,这种情况则必须在灭菌前开展老化验证。
当产品用多个包裹或多层包装时,可以对内外层材料的性能设定不同的限量,如双层皱纹纸包装可采用不同的厚度等。
表3-10、表3-11列出了包装材料经环氧乙烷灭菌、γ射线灭菌老化前后的物理性质变化情况。试验密封条件:温度为290℉(143℃),保持时间为1 s,压力(通过薄膜的密封)为90 lb/in2(621 kPa)。
表3-10 包装材料经环氧乙烷灭菌后5年实时老化前后的物理性质
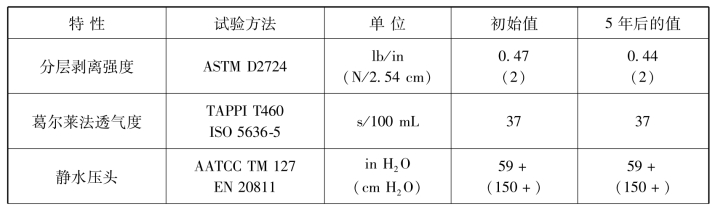
续表
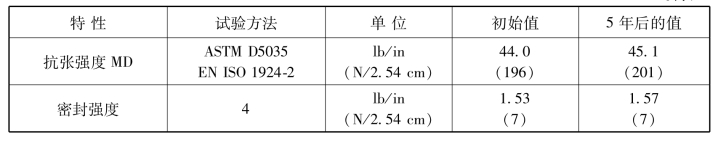
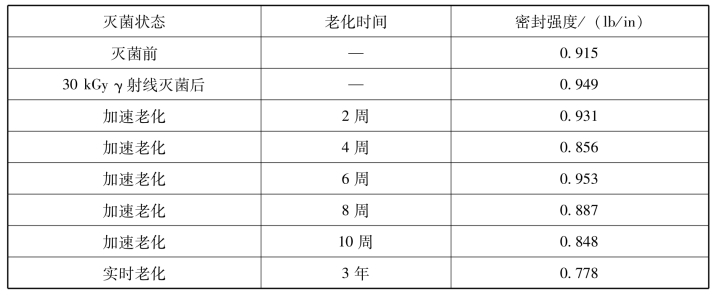
表3-11 包装材料经γ射线灭菌后加速老化和实时老化的密封强度
5.规定的灭菌过程可包括多次经受同一灭菌过程或不同的灭菌过程
产品需要多次经受同一灭菌过程或不同灭菌过程的原因有很多,如某些产品的灭菌过程可能会失败,需要多次灭菌;某些器械先作为一个独立包装经受适当的灭菌过程,然后又作为某个综合器械包的配件需要经受另一个相同或不同的灭菌过程。显然,如果产品需要经受多次相同或不同的灭菌过程,则所使用的包装材料也必须满足这些要求。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




