(1)包装材料的安全性可以系统地通过测试以及从包装供应商获得的认证中了解。无菌屏障系统材料和医疗器械之间的任何反应一般由医疗器械制造商单独确定。
(2)对无菌屏障系统和(或)包装系统及其成分的安全性的追溯通常由医用包装制造商保持,以用于调查确定任何不符合项的根本原因。
(3)包装材料应无毒。ISO 10993(GB/T 16886)、ASTM F2475提供了评估生物相容性的指南。ISO 10993有多个分标准,其中,ISO 10993-7(GB/T 16886.7)《医疗器械生物学评价第7部分:环氧乙烷灭菌残留量》、ISO 10993-10(GB/T 16886.10)《医疗器械生物学评价第10部分:刺激与皮肤致敏试验》、ISO 10993-11(GB/T 16886.11)《医疗器械生物学评价第11部分:全身毒性试验》是关于这类产品的要求。另外,有一些医疗器械产品对包装材料的溶血性验证有特定要求。
(4)尽管医用包装法规没有要求,但在评价包装材料毒理学特性时通常首先参考食品包装法规,如FDA 21CFR 170-189、BFR36ⅩⅩⅩⅥ,以及欧洲委员会关于预期与食品接触的材料和物品的10/2011号法规。生物相容性测试通常按照特定的使用情况进行。在欧洲根据纸张的特性通常有几项化学检测比较重要,如甲醛、多氯联苯、五氯苯酚、纸张杀菌剂的迁移等。有的还要求检测硫酸根和氯离子的残留等项目。由于灭菌包装材料不直接接触人体,一般符合直接接触性食品包装材料的要求就可以了,除非另有特殊用途的要求。包装材料生产厂家可参照EN 868-2、EN 868-3、EN 868-6、EN 868-7或YY/T 0698.2、YY/T 0698.3、YY/T 0698.6、YY/T 0698.7的相关要求出具报告。按GB/T 7974标准测定时,纸的荧光亮度(白度)应不大于1%;UV照射源在距离25 cm处照射,每0.01m2上轴长大于1mm的荧光斑点的数量应不超过5处。
包装材料初始污染菌在我国有比较明确的要求,可参照被包装的无菌医疗器械初始污染菌的要求进行验证。
(5)基于安全考虑,以及可萃取物可能从包装材料中随时间而析出,潜在污染医疗器械或环境,ASTM D4754标准提供了与可萃取物有关的指南,使用液膜蒸馏器(FDA)移动元件进行测试槽对塑料制品的双侧液体提取的标准试验方法用于可萃取物的测试。
最终包装材料应无毒。毒性评估的指导可从ASTM F2475、医疗器件包装材料生物相容性评价标准指南以及ANSI/AAMI/ISO 10993-1评估和检测中获取。ASTM F2475为相关无菌屏障系统和器械提供生物相容性测试的指导说明。由于材料与器械接触,灭菌过程对材料性能可能造成重大影响,应评价灭菌对生物相容性的影响。(https://www.xing528.com)
(6)生物相容性的测试范围非常广泛,对于材料的社会关注也在增加。天然的橡胶乳液、动物源性材料、同种异体材料、增塑剂、加利福尼亚65号议案的致癌物(California Proposition 65 Carcinogens)以及重金属等都是需要关注的检测实例。ASTM D3335标准中采用的原子吸收光谱检测涂料中低浓度铅、镉和钴的试验方法,或ASTM D3718标准中采用的原子吸收光谱检测涂料中低浓度铬的试验方法可以提供有关重金属的更多信息。美国东北州州长联合会(CONEG)的要求也是非常严格的,规定铅、镉、汞和六价铬的总量不得超过百万分之一百。
表3-2是个比较全面的测试内容举例:采用ISO 10993和《美国药典》(USP)的试验方法对某医疗包装材料进行生物学评价,应满足所有可接受的性能要求。材料试样通过环氧乙烷、γ射线和电子束灭菌等方法灭菌后进行测试,证明包装材料在灭菌后满足所有合格性能指标。
表3-2 某包装材料试样的毒理学评价结果
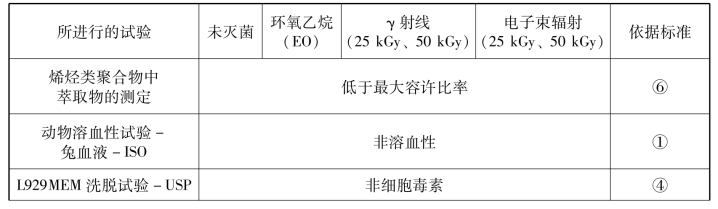
续表
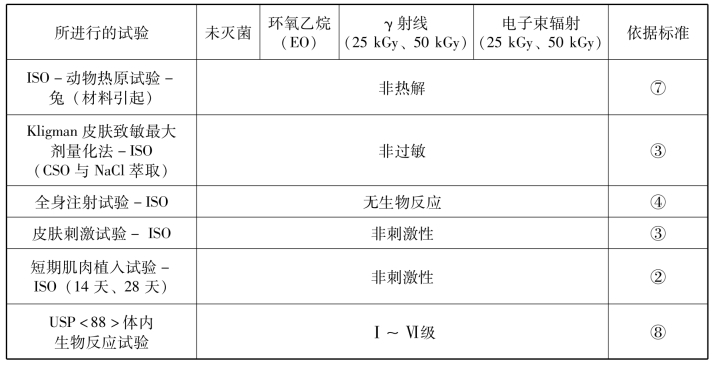
注:包装材料生物相容性及毒理学的评价基于以下标准进行试验:
①ISO 10993-4《医疗器械生物学评价第4部分:与血液相互作用试验选择》。
②ISO 10993-6《医疗器械生物学评价第6部分:植入后局部反应试验》。
③ISO 10993-10《医疗器械生物学评价第10部分:刺激与皮肤致敏试验》。
④ISO 10993-11《医疗器械生物学评价第11部分:全身毒性试验》。
⑤ISO 10993-12《医疗器械生物学评价第12部分:样品制备与参照材料》。
⑥美国联邦法规汇编第21篇177.1520有关烯烃类聚合物的规定,标题21,第1章。
⑦ASTM F981《用于评估外科植入物的生物材料与骨骼肌和插入物材料效应的兼容性的标准实施规程》。
⑧《美国药典(国家处方集)》USP<88>体内生物反应性试验。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




