无菌屏障系统是无菌医疗器械一个关键且不可分割的组成部分,是产品及医患人员安全的基本保证。有效的无菌包装系统是确保产品的安全性和有效性、减少医源性感染的发生、保护患者与医护人员健康的重要防线。从无菌角度考虑,在选择医疗器械包装材料时,要考虑产品打开使用之前包装应具备维持无菌的能力。在建立无菌屏障系统过程中,所用材料的微生物屏障特性对保障包装完好性和产品的安全十分重要。微生物屏障性能好的包装材料,即使在高污染环境中最苛刻的条件下,也能阻挡细菌孢子和其他污染微生物的渗透,在不损坏包装完整性的条件下为医疗器械提供持久的无菌保障。
(一)微生物屏障特性评价方法分类
(1)若能提供客观证据证实材料的不透气性,则该材料就能满足微生物屏障要求。按ISO 5635-5标准进行透气性试验。试验准则:不少于1 h后,内圆筒应无可见移动,允差为±1 mm。包装材料进行不透气性试验的目的是确认材料是否属于不渗透材料(或称为不透气材料)。GB/T 19633.1标准中的附录C提供了《不透气材料阻气体通过的试验方法》,可以依据此方法进行透气性试验确认。采用EN 868-5标准附录B、原国家卫生部发布的《消毒技术规范》中的方法,即染料溶液透过法进行试验,对一般已知的各种材质的薄膜或复合薄膜经证实规定的染料溶液是不可透过的,则可证实该材料微生物屏障性能是合格的。
(2)多孔材料应能提供适宜的微生物屏障,以保证无菌包装的完好性和产品的安全性。无菌屏障系统可防止细菌和病毒随着悬浮微粒进入医疗器械。微生物孢子可以作为单独的实体或群落存在,或附着于非生物微粒(如灰尘)。入侵微粒的大小一般在0.2~100μm,0.2μm是最小的病毒,100μm是在空气中长时间悬浮的尺寸最大的尘埃微粒。过滤理论认为,透气性材料可通过以下三种机制去除气流中的微粒:
①拦截:当纤维过滤器分裂携带微粒的气流时,这种情况就会出现。微粒继续沿其原始路径运行,并与纤维发生碰撞。因此,拦截是一个恒定的微粒去除机理,是纤维材料结构的一个固有功能,与微粒的质量和速度无关。
②惯性碰撞:这种情况会出现在一定质量的微粒偏离了纤维周围的气流而与纤维发生碰撞时。这种捕获方法的成效直接取决于微粒的质量和气流的速度。气流的速度越快,微粒的质量越大,它与纤维发生碰撞的概率就越大。
③扩散:这是一种受微粒随机运动(布朗运动)和静电引力(对于一些材料)影响而形成的微粒拦截方法。这种捕获机制的有效性与微粒的质量和气流的速度呈负相关。微粒越轻,速度越慢,捕获概率越大。
这三种机制对各种流速和所有微粒大小均有效。以较快速度移动的较大质量微粒更有可能因惯性碰撞而被捕获,以较慢速度移动的较轻微粒更有可能因扩散而被捕获。
多孔材料的微生物屏障特性评价通常是在规定的试验条件(通过材料的流速)下使携有细菌芽孢的气溶胶或微粒流经样品材料,从而对样品进行挑战试验。在规定的试验条件下,将通过材料后的细菌或微粒的数量与其初始数量进行比较,确定材料的微生物屏障特性。将经过确认的物理试验方法与经过确认的微生物挑战法进行比对,其所得的数据也可用于确定微生物屏障特性。如美国ASTM F2638标准中采用气溶胶替代测量多孔性材料微生物阻隔性能的方法,该方法可快速便捷地测试多孔材料的微生物屏障特性。国际上评价透气性包装材料或多孔性包装材料的微生物屏障性能的常用方法有美国的ASTM F1608、ASTM F2638,以及欧盟的DIN 58953、EN 868-3、EN 868-6、EN 868-7中的一些方法。
ISO 11607-1附录B中介绍了透气性材料微生物屏障试验方法,原国家卫生部发布的《消毒技术规范》中的方法也是其中之一(等同DIN 58953标准,该标准已转化为YY/T 0681.14《无菌医疗器械包装试验方法第14部分:透气包装材料湿性和干性微生物屏障试验》)。这是一个广泛采用的对透气性材料微生物屏障性能进行筛选的验证方法。
ASTM F1608标准(YY/T 0681.10《无菌医疗器械包装试验方法第10部分:透气包装材料微生物屏障分等试验》)对透气性材料微生物屏障进行了定量分级,可以根据被灭菌物品的性质进行包装材料的选择。原国家卫生部发布的《消毒技术规范》将医疗用品消毒水平分为低、中、高三个危险性水平。低危险性物品2级微生物屏障可满足要求,中危险性物品2.5级微生物屏障可满足要求,高危险性物品则要求3级以上微生物屏障,介入和植入类产品应采用更高的级别。需要指出的是,只有所有透气性材料在试验条件(人为设定的条件,并非真实的工作条件,设定极端条件是为了把微生物屏障材料分出级别)下都不能100%阻菌,才能把材料的性能分出级别。2级是指微生物在极端条件下穿透的可能性为1%,3级是指微生物在极端条件下穿透的可能性为0.1%,依此类推。根据被灭菌物品的性质选择不同级别的包装材料是最有效、最经济的方案。一般要求一次性无菌医疗器械使用的包装材料的微生物屏障级别应在2.5级以上。适用于不透性材料和多孔材料的评价要求如下:
①材料在规定条件下应无可沥滤物并无味,不对与之接触的医疗器械的性能和安全性产生不良影响。
②材料上不应有穿孔、破损、撕裂、皱褶或局部厚薄不均等影响材料功能的缺陷。
③材料的质量(每单位面积质量)应与规定值一致。
④应具有可接受的清洁度、微粒污染和落絮水平。
⑤满足已确立的物理性能,如抗张强度、厚度差异、撕裂度、透气性和耐破度。
⑥满足已确立的化学性能,如pH、氯化物和硫酸盐含量,以满足医疗器械、包装系统或灭菌过程的要求。
⑦材料在使用条件下,不论是在灭菌前、灭菌中还是灭菌后,应不释放出足以引起健康危害的毒性物质。
(二)微生物屏障试验
微生物屏障试验是针对包装材料的,原材料制造商应提供验证报告产品。无菌屏障系统和预成型无菌屏障系统生产企业使用其供应商的报告应是合法有效的。
图3-1给出了微生物屏障鉴定程序,其中上半部分是针对包装材料的,下半部分是针对无菌屏障系统和预成型无菌屏障系统的。
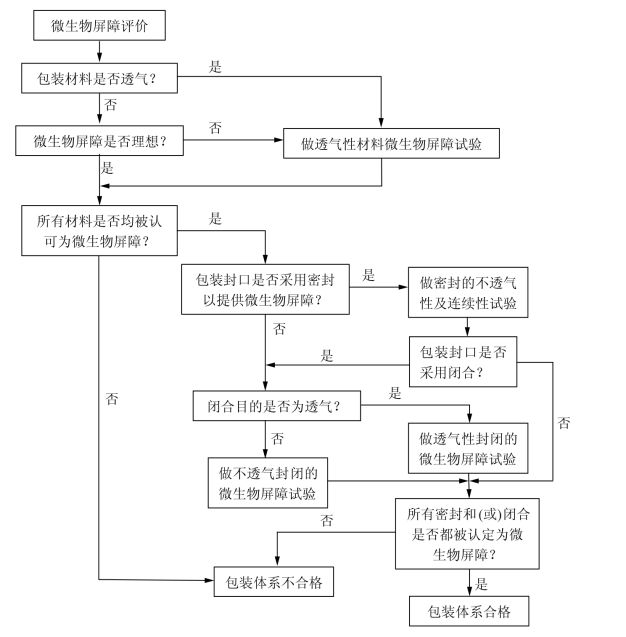
图3-1 微生物屏障鉴定程序
美国ASTM F1608标准和原国家卫生部发布的《消毒技术规范》中的方法均为生物学方法,可作为产品研发的验证。ASTM F1608标准的方法在美国仅有十几个实验室可做(2007年的数据),工厂无法用该方法控制生产,也无法按该方法提供批次检测报告给用户(如果有,也是第三方报告)。很多公司常用一些物理学指标间接证实产品的微生物屏障性能,当然这些方法和指标是与生物学方法认真比对过的。
在欧洲常用纸张的孔径、水的透过能力、吸水量(EN 868-3、EN 868-6、EN 868-7,YY/T 0698.3、YY/T 0698.6、YY/T 0698.7)三项指标来证实产品的微生物屏障性能。这些物理指标比较直接,容易用简单的方法来证实,在包装材料的实际生产过程中有着重要意义。
微生物屏障性能是选择包装材料和预成型无菌屏障系统时必须要特别关注的。无论生产企业采取何种方法检测,都应提供产品在进入市场前的生物学验证报告,同时提供该批产品出厂前能间接证实微生物屏障性能的物理、化学等方面的自检报告并保存记录原始数据,以便于相关事件的追溯。
无菌屏障材料验证报告或无菌屏障材料符合GB/T 19633或ISO 11607的验证文件,由包装材料制造商、预成型无菌屏障系统的制造商、第三方检验机构或医疗器械制造商提供。验证报告应至少包含以下特性:
(1)微生物屏障。
(2)生物相容性和毒理学特性。
(3)物理和化学特性。(https://www.xing528.com)
(4)与成型和密封过程的适应性。
(5)与预期灭菌过程的适应性。
(6)灭菌前和灭菌后的贮存寿命。
(三)包装材料微生物屏障性能分级方法及对应医疗器械的使用原则
根据美国ASTM F1608《多孔包装材料的微生物分等标准试验方法(开放室法)》标准测量多孔无菌屏障材料防止细菌孢子渗透的能力。该试验检测基材从悬浮微粒中去除孢子的过滤效率,悬浮微粒能够通过基材压入气流。试验采用的流速为2.8 L/min,每一取样口的孢子浓度为106CFU。屏障的衡量标准为对数下降值(LRV),是试样组和对照组的常用对数的差值。
完全不能渗透的对照试样(微生物渗透率为零)在106CFU的挑战下,LRV值为6(lg106=6)。如果一个与对照试样面临相同挑战的试样允许10 CFU(lg10=1)渗入,则其对数下降值(LRV)为5(6-1=5)。因此,对数下降值(LRV)越高,包装材料抗微生物的能力就越强。LRV是对数指标,每一个单位对应于微生物的渗入实际数量10倍的关系。如LRV=5与LRV=3比较,意味着LRV=5材料的阻隔能力是LRV=3材料的100倍。综合保存期研究分析总结表明,在不损坏包装完整性的条件下,高指标的LRV材料通常会有较长的无菌状态保持时间。但此试验方法有两个缺点:一是培养孢子以得到一组穿透试验材料的孢子需要很长时间;二是试验方法结合了高流速,除了在高压蒸汽灭菌器或环氧乙烷(EO)灭菌器中快速抽空或减压外,医疗器械包装中从未出现过这种流速。已经生成的数据表明,无菌包装常用的透气材料的最大穿透点一般会在低于ASTM F1608标准测试所用流量的条件下产生,见表3-1。
表3-1 包装材料在包装、配送、处理、测试期间遇到的气流流量比较

ASTM F2638《使用气溶胶过滤测量替代微生物屏障的多孔包装材料性能的标准试验方法》解决了这些问题。该试验计量不同的速度穿透屏障材料的惰性微粒数值,这个速度接近于它们在输送过程中的实际状况。试验中使用了不同的流速,从而产生一条穿透曲线。在该穿透曲线上,多数试验的基材有最大值,因此可以得出特定基材的最大微粒渗透率Pmax。该最大值产生的流速取决于质量、纤维直径和基材密度。
由于在测试过程中未使用实际生物体或孢子,因而无须灭菌处理、平皿接种或培养过程。此外,可用微粒计数器进行实时计数处理。与ASTM F1608不同,ASTM F2638测试方法无须在生物实验室内进行,该测试几乎可在任何地方进行,也可在多种流量下进行,以模拟产品处在不同的配送和处理条件,如图3-2所示。
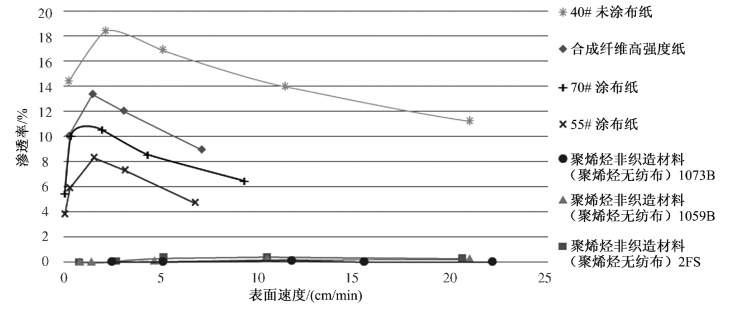
图3-2 多孔无菌屏障材料的微粒渗透率(ASTM F2638)
按ASTM F2638标准方法实际测量的是多孔基材防止微粒渗透的能力,微粒渗透与微生物孢子渗透高度关联,所有材料均具有出现最大微粒渗透率(Pmax)的表面速度。渗透率越低,性能越好。
上述两个方法均未考虑湿态微生物屏障性能验证方案,但微生物污染可能通过空气或水传播。在美国普遍认为湿态细菌屏障的性能由包装材料的隔水能力决定,可以通过材料的阻水性能的物理学验证证明,没有必要进行生物学验证。但一些材料本身含有一定的水分,如纸张、纤维织物等。由于含水量不同会造成湿态屏障性能的显著差异,对于这些材料按DIN 58953-6(YY/T 0681.14)标准进行验证还是很有必要的。另外,无菌物品保存的环境湿度可能存在显著差异,这些因素也是需要考虑的。
(四)高风险无菌医疗器械包装材料微生物屏障性能验证
设定包装完整性保持无菌性能至少5年,在5年保存期内的试验可以按实际时间的方案进行。
1.初始灭菌性能测试包装内装物
用4.25 in×6.75 in(10.8 cm×17.1 cm)的特殊包装密封敞开的培养皿,该特殊包装用于模拟包装中密封的一次性医疗器械,然后采用环氧乙烷(EO)给包装和内装物灭菌。每个包装均由密封于聚对苯二甲酸乙二酯薄膜的×××材料组成。
为确保在长期货架贮存前培养皿无菌,按照《美国药典》(USP)中厌氧菌和需氧菌的试验方法,随机测试试样的厌氧微生物污染,然后将培养皿从打开的包装中取出,置于含液体硫基乙酸盐培养基或大豆酪蛋白消化液的无菌袋内。
2.大量添加细菌孢子的保存包装
将含无菌培养皿的包装保存在不受外界污染的柜内架子上,并且在控制的温度、湿度下保存。在整个5年测试期内,每4个月给每个包装喷上大剂量的均匀环状芽孢杆菌孢子。每个包装上的实际孢子量为4 000~5 000个。
3.定期检查包装无菌状态
为检查包装无菌状态,每6个月从贮存架上随机取出10个包装,同时给poly-Mylar®薄膜的外表面消毒。采用铅笔尖大小的热烙铁给poly-Mylar®薄膜和培养皿穿一小孔,然后将15mL无菌营养琼脂注入培养皿,用杀菌剂胶带封住入口。如果有孢子穿透×××材料盖,它们在培育后将在培养基上生长。研究过程中未在任何试样上检测到孢子。
4.检查×××材料是否有可能的细菌生长
试验程序的最后部分确定了包装确实是受到了来自×××外的细菌孢子的挑战。从包装盖上切小部分×××样片,置于琼脂培养基上,细菌生长后,在显微镜下检查样片并计算环状芽孢杆菌的菌落。其作用是检查实际在×××表面上的活孢子数量,也保证了在多年试验期间始终保持孢子的密度。
(五)无菌屏障系统可能需要提供的其他和穿透有关的验证
例如,需要验证某些气体或光的穿透。气体穿透与透气性是两个不同概念,气体穿透是指气体分子以非常缓慢的方式穿透固体材料。
若医疗器械需要保持潮湿的环境或对潮湿非常敏感,或受氧气或其他气体影响,则要求包装材料能持续提供特定的气体或蒸气屏障。
水蒸气穿透在ASTM F372和ASTM F1249中有所描述,氧气穿透可以按照ASTM D3985的指南量化,光的穿透量化可以通过光谱学和预知所关注的光的波长完成。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




