一、传质机理
传质现象:物质在一相内部和两相之间发生质量转移的现象称之为质量的传递,即传质现象。吸收过程和精馏过程一样同属气液传质过程。
溶质在气相或液相中的传递是通过扩散作用进行的,扩散作用有两种基本方式,即分子扩散和涡流扩散。
分子扩散:以浓度差作推动力,溶质分子在静止或呈层流流动的液体中作无规则运动,使得溶质扩散至溶剂中的传递现象。分子扩散速率主要取决于扩散物质溶质和溶剂流体的温度和挥发度。
例如,将浓氨水试剂瓶盖打开,马上就能在较远的地方闻到氨气气味。
涡流扩散:在传质设备中,流体的流动状态多为湍流,流体质点除作轴向运动外,同时作径向脉动,质点间发生相互碰撞而迅速混合。溶质凭借流体质点的湍动和漩涡进行传递的现象称为涡流扩散。涡流扩散速率远远大于分子扩散速率,湍流扩散速率主要取决于流体的流动形态。
例如,用劲将烧杯中的清水搅动让其形成涡流,再滴加墨水,其颜色迅速分布于水中,将墨水滴加到静止的水杯中,颜色分布速度明显慢很多。
在湍流流体中,分子扩散与涡流扩散同时发挥着传质作用,在湍流主体中质点传递的规模和速度远远大于单个分子,因此,涡流扩散的效果占主要地位。
对流传质:对流传质,又称质对流,通常指在运动着的流体与相界面之间的质量交递过程。这种过程既包括由流体位移所产生的对流作用,同时也包括流体分子间的扩散作用,也就是说,对流传质包括湍流主体中发生的涡流扩散和层流内层的分子扩散。
二、吸收相平衡
(一)亨利定律
在恒定温度与压力下,使某一定量混合气体与吸收剂接触,溶质便向液相中转移,当单位时间内进入液相的溶质分子数与从液相逸出的溶质分子数相等时,吸收达到了相平衡。此时液相中溶质达到饱和,气液两相中溶质浓度不再随时间改变。
在低浓度吸收操作中,对应的气相中溶质浓度与液相中溶质浓度之间可用亨利定律描述:当总压不高,在一定温度下气液两相达到平衡时,稀溶液上方气体溶质的平衡分压与溶质在液相中的摩尔分数成正比,即
或
式中 p*——溶质在气相中的平衡分压,kPa
E——亨利系数,kPa
y*——相平衡时溶质在气相中的摩尔分数
x——溶质在液相中的摩尔分数
m——相平衡常数,m=E/P
亨利系数E的值随物系而变化。当物系一定时,温度升高,E值增大。亨利系数由实验测定,一般易溶气体的E值小,难溶气体的E值大。由于气液相组成表示方法不同,亨利定律可有多种形式。
(二)相平衡关系在吸收过程中的应用
1.判别过程的方向
对于一切未达到相际平衡的系统,组分将由一相向另一相传递,其结果是使系统趋于相平衡,所以,传质的方向是使系统向达到平衡的方向变化。一定浓度的混合气体与某种溶液相接触,溶质是由液相向气相转移?还是由气相向液相转移?可以利用相平衡关系作出判断。下面举例说明。
【例11-1】设在 101.3kPa、20℃下,稀氨水的相平衡方程为y*=0.94x,现将含氨摩尔分数为10%的混合气体与x=0.05的氨水接触,试判断传质方向。若以含氨摩尔分数为5%的混合气体与x=0.10的氨水接触,传质方向又如何?
解:实际气相摩尔分数y=0.10。根据相平衡关系与实际x=0.05的溶液成平衡的气相摩尔分数y*=0.94 ×0.05 =0.047
由于y>y*故两相接触时将有部分氨自气相转入液相,即发生吸收过程。
同理,此吸收过程也可理解为实际液相摩尔分数x=0.05,与实际气相摩尔分数y=0.10成平衡的液相摩尔分数 ,x<x*,故两相接触时部分氨自气相转入液相。
,x<x*,故两相接触时部分氨自气相转入液相。
反之,若以含氨y=0.05的气相与x=0.10的氨水接触,则因y<y*或x*<x,部分氨将由液相转入气相,即发生解吸。
2.指明过程的极限
将溶质摩尔分数为y1混合气体送入某吸收塔的底部,溶剂从塔顶淋入塔,作逆流吸收,如图11-5所示。当气液两相流量和温度、压力一定情况下,设塔高无限(即接触时间无限长),最终完成液中溶质的极限浓度最大值是与气相进口摩尔分数y1相平衡的液相组成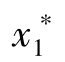 ,即(https://www.xing528.com)
,即(https://www.xing528.com)
图11-5 逆流吸收塔
y2—完成吸收后出塔气体中,吸收质与惰性气体的摩尔比L—贫油(稀液)中吸收剂的流量(kmol/h)V—混合气体中惰性气体的流量(kmol/h)y1—进入吸收塔前混合气体中,吸收质与惰性气体的摩尔比x1—完成吸收后出来的富油(浓液)中,吸收质与吸收剂的摩尔比x2—进入吸收塔前贫油(稀液)中吸收质与吸收剂的摩尔比
同理,混合气体尾气溶质含量y2最小值是进塔吸收剂的溶质摩尔分数x2相平衡的气相组成 ,即
,即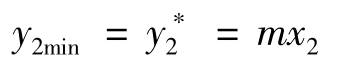
由此可见,相平衡关系限制了吸收剂出塔时的溶质最高含量和气体混合物离塔时最低含量。
3.计算过程的推动力
相平衡是过程的极限,不平衡的气液两相相互接触就会发生气体的吸收或解吸过程。吸收过程通常以实际浓度与平衡浓度的差值来表示吸收传质推动力的大小。推动力可用气相推动力或液相推动力表示,气相推动力表示为塔内任何一个截面上气相实际浓度y和与该截面上液相实际浓度x成平衡的y*之差,即y-y*(其中y*=mx)。
液相推动力即以液相摩尔分数之差x*-x表示吸收推动力,其中 。
。
图11-6 双膜理论模型示意图
p—气相主体中吸收质分压pi—气相中气膜内层吸收质分压ZG—气膜厚度ZL—液膜厚度c—液相主体中吸收质的浓度ci—液相中液膜内层吸收质浓度
三、吸收机理
吸收是溶质从气相转移到液相的传质过程。吸收过程可以用双膜理论解释,如图11-6所示。
1.双膜理论的主要论点
(1)在传质过程中,气液两相间有一个稳定的相界面,相界面两边分别是气体薄膜和液体薄膜。在任何流动状态下,气膜和液面内的流体都呈现层流状态,而膜内靠分子扩散传质。
(2)气膜和液膜均很薄,但气体吸收的阻力主要集中在气膜和液膜中。
(3)不论何时,在相界面上气液两相都会达到平衡。
2.吸收步骤
(1)溶质从气体主体对流扩散到气膜边界,完成气相内的物质传递过程,即将冲破气膜。
(2)溶质以分子扩散的方式通过气膜到达气液两相界面,溶质冲破气膜到达两相界面,即将与溶剂接触。
(3)溶质以分子扩散的方式由两相界面通过液膜到达液膜边界,溶质在两相界面上被溶剂溶解。
(4)溶质由液膜边界以对流扩散方式进入液体主体,成为溶液。
四、吸收速率及提高吸收速率的措施
1.吸收速率定义
吸收速率是指单位相际传质面积上时间内吸收剂吸收的吸收质的量。
吸收速率=吸收系数×推动力,或吸收速率=推动力/阻力。
其中传质推动力为浓度差值,阻力与吸收系数互为倒数。相际间传质总推动力为气液两相传质推动力之和,相际间传质总阻力为气液相传质阻力之和。
2.提高吸收速率的措施
(1)对于溶解度大的易溶气体,液膜的阻力很小,吸收的总阻力主要集中在气膜内,气膜阻力控制着整个吸收过程速率。要提高易溶气体的吸收速率,主要依靠增大气相的湍动程度。
(2)对于溶解度很小的难溶气体,气膜的阻力很小,吸收的总阻力主要集中在液膜内,液膜阻力控制着整个吸收过程速率。要提高难溶气体的吸收速率,主要依靠增大液相的湍动程度。
(3)对于中等溶解度的气体,气膜阻力和液膜阻力均不可忽视,吸收总阻力等于气膜阻力和液膜阻力之和。要提高中等溶解度气体的吸收速率,必须同时加大主要气相和液相的湍动程度。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




