一、蒸馏
(一)蒸馏的定义
蒸馏是分离液体混合物的典型单元操作。它是利用液体混合物中各组分挥发度不同的特性,通过加热造成气液两相物系,汽相富集轻组分,液相富集重组分,从而实现轻重组分分离的方法。
(二)蒸馏的分类
1.操作流程分类
按操作流程分类,蒸馏分为间歇蒸馏和连续蒸馏。
(1)间歇蒸馏:也称简单蒸馏,一次进料一次出料。
(2)连续蒸馏:连续进料,连续出料。
2.蒸馏方式分类
按蒸馏方式分类,蒸馏分为简单蒸馏、平衡蒸馏和精馏。
(1)简单蒸馏:为间歇操作过程,如图10-6。将一批料液加入蒸馏釜中,在恒压下加热至沸腾,使液体不断汽化,陆续产生的蒸汽经冷凝后作为顶部产品,其中易挥发组分相对地富集于顶部产品。在蒸馏过程中,气、液相的组成不断变化,即,塔顶蒸气和塔釜液体的易挥发组分含量均不断下降,难挥发组分均不断增加。因此,通常情况下,顶部产物要分罐收集,最终将釜液一次排出。
图10-6 简单蒸馏装置
1—蒸馏釜 2—冷凝器3,4,5—产品接收器
(2)平衡蒸馏:又称闪蒸,是连续定态过程,其流程如图10-7所示。原料经泵加压后连续地进入加热器,在加热器内被加热升温至高于分离器压力下的沸点,然后经节流阀减压突然将压强降至预定压强喷出,原料即成为过热液体,其高于沸点的显热随即转变为潜热发生自蒸发,液体部分汽化,使得气、液两相在分离器中分开,气相经塔顶冷凝器成为塔顶产品,易挥发组分增浓,塔釜液难挥发组分也获得了增浓。
(3)精馏:是把液体混合物进行多次部分气化,同时又把产生的蒸气多次部分冷凝回流,使混合物分离为所要求组分的操作过程。精馏是工业上应用最广的液体混合物分离操作,广泛用于石油、化工、轻工、食品、冶金等部门。精馏操作按操作方式,可分为连续精馏和间歇精馏;按混合物的组分数,可分为二元精馏和多元精馏;按是否在混合物中加入影响汽液平衡的添加剂,可分为普通精馏和特殊精馏(包括萃取精馏、恒沸精馏、加盐精馏);按操作压力,可分为常压精馏、减压精馏、加压精馏。
图10-7 平衡蒸馏装置
1—加热器 2—节流阀 3—分离器F—进料量y—塔顶气相轻组分含量D—塔顶气相产品量W—塔釜产品量x—塔底产品轻组分含量Q—加热物料所需热量xF—进料中轻组分含量
本项目重点讨论在常压条件下,双组分连续精馏。
二、双组分溶液的气液相平衡
(一)相关概念
(1)蒸馏分离的物系:由加热至沸腾的液相与其产生的蒸汽相构成。
(2)汽液相平衡关系:是指溶液与其上方蒸汽达到平衡时,气液两相间各组分之间的关系。
(3)理想物系:是指液相为理想溶液、气相为理想气体的物系。其液相遵循拉乌尔定律,气相遵循道尔顿分压定律。
(4)饱和蒸气压:在密闭容器中,在一定温度下,纯组分液体的气液两相达到平衡状态时其蒸气所具有的压力。
(二)相平衡关系式
(1)拉乌尔定律:当气液达平衡时,溶液上方组分的蒸气压与溶液中该组分的摩尔分率成正比。也就是,达平衡时,气相中任一组分的分压等于该(纯)组分在该温度下的饱和蒸气压po乘以它在溶液中的摩尔分数。即
式中 pA,pB——溶液上方A和B两组分的平衡分压,Pa
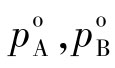 ——同温度下,纯组分A和B的饱和蒸气压,Pa
——同温度下,纯组分A和B的饱和蒸气压,Pa
xA,xB——混合液组分A和B的摩尔分数
对于大多数溶液来说,拉乌尔定律只有在浓度较低的溶液,在全部浓度范围内服从拉乌尔定律的溶液视为理想溶液。
(2)道尔顿分压定律:理想物系达到平衡时,上方蒸气总压等于各组分分压之和。即
将拉乌尔定律代入式(10-3)中,即
整理得泡点方程式
泡点方程表示平衡物系的温度与液相组成的关系。
(3)泡点:在一定压强下,液体混合物开始沸腾出现第一个气泡时的温度,称为泡点温度(简称泡点)。
同理,溶液上方蒸气的组成yA为露点方程
露点方程表示平衡物系的温度与气相组成的关系。
(4)露点:在一定压强下,蒸气混合物沸腾出现第一个液滴时的温度,称为露点温度(简称露点)。
泡点和露点方程的适用条件为理想物系。
严格而言,实际上理想溶液是不存在的。对于一些由同分异构体和分子结构相似、性质极相近的组分组成的溶液,如苯-甲苯、甲醇-乙醇、四氯化碳-四氯化硅等溶液都具有理想溶液的特征,可视为理想溶液。
(三)气液平衡相图
由相平衡关系式可知,当液体混合物的组成确定时,达相平衡后,其气液相关系就确定,这种关系可用相图直观表达。在双组分精馏中应用相图使得计算过程更为简便,而且影响精馏过程的因素可在相图上直接予以反映。常用的相图为恒压下的t—x—y图和y—x图。
1.t—x—y图
图10-8是在总压为101.33kPa下,苯-甲苯混合液的t—x—y图,通常,t—x—y关系的数据由实验测得,对于理想溶液,也可由纯组分的饱和蒸气压数据进行计算。(https://www.xing528.com)
图10-8中有两条曲线,下方曲线为t—x线,代表平衡时,泡点温度与液相组成之间的关系,即液相混合物的组成不同,其泡点温度随之变化,此曲线称为饱和液体线或泡点线。上方曲线为t—y线,代表平衡时露点温度与气相组成之间的关系,此曲线称为饱和蒸气线或露点线。
图10-8 苯-甲苯混合液的t—x—y关系
上述两条线将t—x—y图分为三个区域,饱和液体线以下区域代表液体尚未沸腾,称为液相区;饱和蒸气线以上区域,表示液体已全部汽化,称为过热蒸气区;两曲线之间区域,表示气液两相同时存在,液相为饱和液体,气相为饱和蒸气,称为气液共存区。
2.y—x图
图10-9是在总压为101.33kPa下,苯—甲苯混合液的y—x图。图中曲线上的点D1表示液相组成为x1(液相苯的摩尔分数),达气液平衡时,其气相组成为y1(气相苯的摩尔分数)。曲线D1D2又称为平衡曲线。
图10-9 苯-甲苯体系的相平衡曲线
对于理想溶液,由于平衡时,气相组成y恒大于液相组成x,故平衡曲线在对角线的上方。平衡曲线偏离对角线走远,表示该混合液越容易分离。
(四)挥发度及相对挥发度
1.挥发度
挥发度是表示物质挥发难易程度的物理量。对于纯物质的挥发度可用该物质在一定温度下的饱和蒸气压来表示。同一温度下,饱和蒸气压越大,表示其挥发性越强。对于混合液体,因组分间的相互影响,使其中各组分的饱和蒸气压要比纯组分的饱和蒸气压低,故混合液体中各组分的挥发度可用气相中某一组分的蒸气分压和与之平衡的液相中的该组分(摩尔分数)之比来表示,以符号ν表示。
对于A和B组成的双组分混合液有:
式中 νA,νB——组分A、B的挥发度
pA,pB——汽液平衡时,组分A、B在气相中的分压
xA,xB——汽液平衡时,组分A、B在液相中的摩尔分数
对于理想溶液,因其服从拉乌尔定律,所以
2.相对挥发度
由于混合液中各组分的挥发度随温度而变,在精馏计算中很不方便,而相对挥发度虽也随温度变化,但变化不大,故引入相对挥发度概念。
相对挥发度是混合液中两组分挥发度之比,以符号α表示。
当操作压力不高时,气相遵循道尔顿分压定律,式(10-12)可表示为:
或
通常情况下,α值由实验测得。对于理想溶液,则有
相对挥发度α值的大小,表示气相中两组分的浓度比是液相中浓度比的倍数。所以α值可作为混合物采用蒸馏法分离的难易标志,若α大于1,y>x,说明该溶液可以用蒸馏方法来分离,α越大,A组分越易分离;若α=1,则说明混合物的气相组分与液相组分相等,则普通蒸馏方式将无法分离此混合物;α<1,则要重新定义轻组分与重组分,使α>1。
对于二元混合物,当总压不高时,可整理得式(10-16a)
由于xA,yA分别为A组分的液、气组成,故xA,yA可去掉下标,得到气液平衡方程
式(10-16b)为气液平衡方程,表示若α为已知时,x—y的关系。
【例10-1】一供应商送来一车正庚烷与正辛烷混合液说,混合液中正庚烷的含量不高于75%(质量分数)。老板要求检验员要尽快拿到检测结果,以证实供应商的说法。在没有色谱仪的情况下,怎么办?
检验员将该混合液置于密闭容器中加热恒温至120℃,测得容器内压力(表压)为64.3kPa,问:该供应商的说法对不?已知120℃时,正庚烷的po=180.0kPa,正辛烷的po=86.6kPa。
解:正庚烷与正辛烷的结构相近,其混合液可视为理想溶液。根据相平衡关系可求得正庚烷的液相组成。
依题意
p总=101.3+64.3=165.6(kPa)
M庚=7 ×12+2 ×7+2=100M辛=8×12+2×8+2=114
求解,得
x庚=0.846
w庚% =0.846 ×M庚/(0.846 ×M庚+0.154 ×M辛)
=0.846 ×100/(0.846 ×100+0.154×114)
=82.8%
答:混合液中正庚烷的液相组成实为82.8%,供应商的说法不对。
(五)非理想溶液的气液相平衡图
非理想溶液是由于异种分子间的作用力不同于同种分子间的作用力,其表现是溶液中各组分的平衡蒸汽压偏离于拉乌尔定律。此偏差可正可负,分别称为正偏差或负偏差溶液。乙醇-水物系和硝酸-水物系的气液相平衡图如图10-10和图10-11所示。
图10-10和图10-11中的交点M均为混合物系的恒沸点,交点处的组成为恒沸组成,表示气相与液相组成相等。用普通蒸馏方法不能分离恒沸溶液。
图10-10 乙醇-水溶液相平衡图
图10-11 硝酸-水溶液相平衡图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




