产生于金属表面向内部扩展的点坑,即空穴的局部腐蚀称为点腐蚀,又称为点蚀、孔蚀或小孔腐蚀,是在金属构件表面出现个别孔坑或密集斑点的腐蚀。
1.失效特征
点蚀发生后的蚀孔直径很小,但沿深度发展,直至发展到穿孔,表面上呈麻点状,坑口覆盖着腐蚀产物。坑口形状有半球形、椭圆形、杯形、袋形、深窄形或浅宽形、复合形状等。点蚀孔的形貌主要受腐蚀物和腐蚀产物在蚀孔及周围介质之间交换时所存在的条件所控制。美国ASTMG1994(2005)中的点腐蚀的各种剖面形状如图5-48所示。实际上也常能观察到受点腐蚀的金属构件这几类点腐蚀的形状。
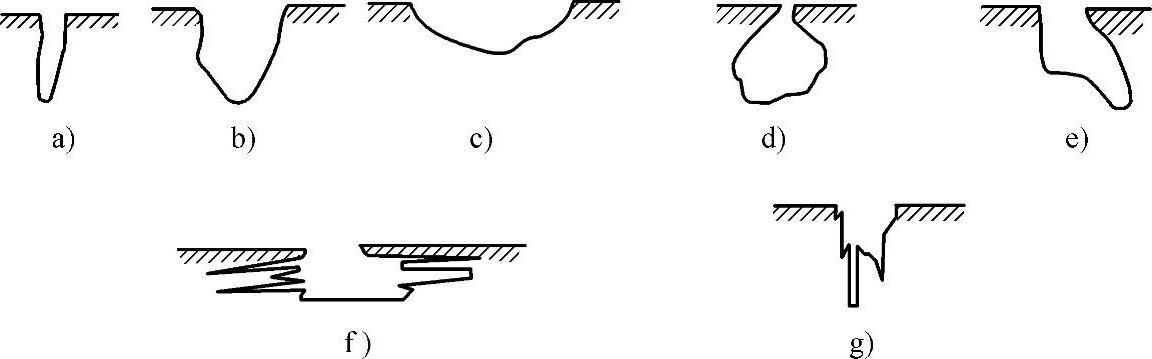
图5-48 点腐蚀的各种剖面形状
a)深窄形 b)杯形 c)浅宽形 d)袋形 e)斜向扩展 f)水平扩展 g)垂直扩展
图5-49所示的不锈钢试样点蚀孔剖面形貌,是不锈钢试样在实验室条件下的氯化物水溶液中浸泡后的点蚀孔剖面形貌,其中图5-49b、c的放大倍数为100倍,图5-49a、d、e的放大倍数为50倍。
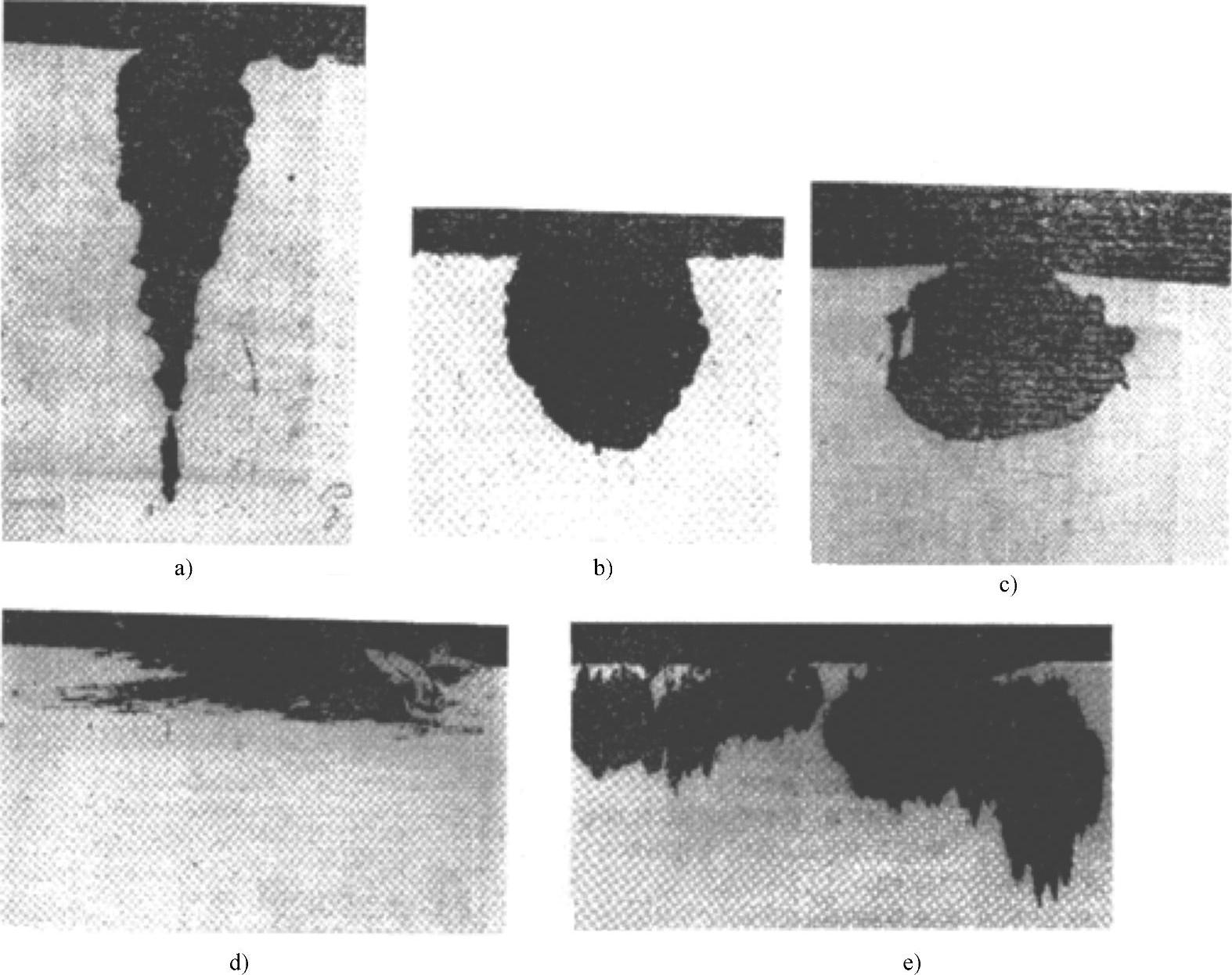
图5-49 不锈钢试样点蚀孔剖面形貌
2.导致失效的条件、应力及失效过程
金属表面的不均匀性如表面缺陷、夹杂和划痕等是点腐蚀的发源地,介质中的卤族元素和氧化剂同时存在有利于点腐蚀的形成和发展,点腐蚀易在介质滞留的区域发生。在金属表面局部缺陷——伤痕、露头、位错、内部夹杂、晶界异相沉积处形成点蚀源,并在化学腐蚀和电化学腐蚀的共同作用下,孔蚀沿重力方向或横向发展,严重时可腐蚀穿透金属。不锈钢和铝合金等材料在介质中含有Cl-时容易产生点腐蚀,如在海水或工业水中或含Cl-的循环冷却水中常发生点蚀。
3.浅点腐蚀与深点腐蚀
如果明显的点腐蚀被界定在相对较大的区域并且不深,称为浅点腐蚀;如果点腐蚀只界定在较小的区域内,而且点蚀孔很深,则称为深点腐蚀。点腐蚀严重程度有时通过术语“点蚀因子”来表示。点蚀因子是点腐蚀最深处的金属穿进深度(p)与构件由重量损失求得的减薄厚度(d)的比值,如图5-50所示。
4.点腐蚀的机理
点腐蚀是一种由小阳极大阴极腐蚀电池引起的阳极区高度集中的局部腐蚀形式。点腐蚀的产生一般经历点蚀孔的形成及点蚀孔的扩展两个阶段。
(1)点蚀孔的形成 金属表面的位错露头、杂质相界、不连续缺陷或金属表面钝化膜和保护膜的破损等部位都可以成为点蚀源,在电解质中,这些部位往往呈活性状态,电位比邻近完好部位要负,两者之间形成局部微电池。局部微电池作用的结果,阳极金属溶解形成了点蚀核,阳极溶解产生的电子流向邻近部位并得到阴极保护。经一段时间的局部微电池作用,点蚀核部位溶出点蚀孔。
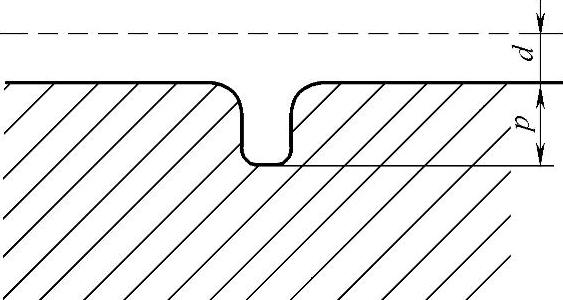
图5-50 点蚀因子=p/d
若介质中含有活性离子如氯离子,能优先吸附于点蚀核部位,或者排挤吸附的HO-、O2-离子,与金属作用形成可水解的化合物,更容易引起金属表面的微区溶解而形成点蚀孔。金属氯化物水解反应表明,其生成腐蚀产物和氯离子,且氯离子能反复作用而不发生损耗。
阳极反应:
Fe→Fe2++2e (5-13)
Ni→Ni2++2e (5-14)
Cr→Cr3++3e (5-15)
阴极反应:
O2+2H2O+4e→4OH- (5-16)(https://www.xing528.com)
氯化物水解反应:
MCln+nH2O→M(OH)n↓+nH++nCl-(5-17)
(2)点蚀孔的扩展 在点蚀孔内由于阳极溶解的金属离子形成的化合物发生水解而生成氯离子,因此蚀孔中的溶液的pH值下降,酸性加强。这样又加速了金属的溶解,从而造成了点蚀孔的扩大与加深。而且腐蚀产物生成后积聚在孔口也使蚀孔内外物质迁移难以进行,孔口的积聚物越来越多,使孔内形成闭塞电池。随着水解反应的继续进行,pH值不断下降,孔内金属离子浓度上升,为了维持电荷平衡,孔外活性的氯离子不断地穿过腐蚀产物向蚀孔内迁移,导致孔内氯离子进一步富集,这就是点腐蚀扩展的“自催化酸化”过程。
点腐蚀以自催化酸化发展下去,使金属构件的蚀孔迅速穿进,以至穿透壁厚,发生介质泄漏。
5.点腐蚀的主要影响因素
影响点腐蚀的因素与金属构件本身的材料成分、组织、冶金质量、表面状态有关,更与金属构件所处的环境条件密切相关,如介质成分、浓度、pH值、温度、流动状态等。
(1)材料 钝化的金属材料有较高的点蚀敏感性,如铬镍奥氏体不锈钢的点蚀敏感性比普通碳钢高。钼、铬、镍、氮等元素能提高不锈钢抗点蚀的能力,而硫、碳等元素则会降低不锈钢的抗点蚀能力。
提高钢的冶金质量,降低有害元素及各种偏析、夹杂物等缺陷,有利于提高抗点蚀能力。在相当于碳化物析出的温度下进行热处理,则点腐蚀数目增多,对铬镍奥氏体不锈钢进行固溶处理可使之得到最好的抗点腐蚀性能。构件粗糙的金属材料表面要比光滑的表面更容易发生点腐蚀。
(2)环境 含氯离子的溶液最容易引起点腐蚀,在实际生产中,许多装备都是在含有不同浓度的氯离子的水溶液中有点腐蚀倾向,其中含有氧化性金属阳离子的氯化物如FeCl3、HgCl2等属于强烈的点腐蚀促进剂。
工作中,提高溶液中氯化物的浓度,将增加不锈钢的点腐蚀倾向。在氯化物的溶液中,加入SO2-4、ClO4-、NO-3和OH-,可起到缓蚀作用,降低不锈钢的点蚀倾向。缓蚀效果按如下次序递减:OH-→NO3-→SO2-4→ClO4-。缓蚀的程度取决于它们的浓度和溶液中Cl-的浓度,Cl-浓度越大,OH-、NO-3、SO2-4、ClO4-的需要量也越大。
在碱性介质中,随着pH值升高,对点腐蚀的抗力增强;在酸性介质中,pH值影响不明显。升高温度一般要增加点腐蚀的倾向。在温度高于100℃时,点腐蚀可产生在没有侵蚀性阴离子的情况下,如碳钢在纯水中观察到有点蚀发生,此时水中含氧仅为10-6数量级。
在静止介质中要比在流动介质中更易发生点腐蚀,因此对溶液进行搅拌、循环或通气都有利于减轻点腐蚀。流体流动能把局部浓度高的氢离子、氯离子及有害离子驱除,减轻积聚。对不锈钢,有利于减轻点蚀的流速为1m/s左右,过高的流速会导致磨损腐蚀。
6.点腐蚀的预防措施
每一种工程金属材料,对点腐蚀都是敏感的,易钝化的金属在有活性侵蚀离子与氧化剂共存的条件下,更容易发生点腐蚀。如不锈钢、铝和铝合金等在含氯离子的介质中,经常发生点腐蚀,碳钢在表面的氧化皮或锈层有孔隙的情况下,在含氯离子的水中也会发生点腐蚀。为了预防点腐蚀,可从构件材料和改善使用环境两方面采取措施。
(1)构件材料 提高材料的耐蚀性,主要从以下几个方面考虑。
1)选用耐点蚀性能良好的金属材料。如采用碳的质量分数低于0.03%的高铬、含钼、含氮的不锈钢。在常用的奥氏体不锈钢中,其耐点蚀性能顺序为304<316<317。目前普遍认为奥氏体+铁素体双相钢及高纯铁素体不锈钢有良好的耐点蚀性能,钛和钛合金有很高的耐点蚀性能。
2)对材料进行合理的热处理。对于Cr-Ni奥氏体不锈钢或奥氏体+铁素体双相不锈钢,在固溶处理状态下,可获得最佳的耐点蚀性能。
3)对金属构件进行钝化处理或在条件允许的情况下做阳极发蓝处理,使其表面膜均匀致密。避免任何天然的和外加的保护膜层的破裂。
(2)改善使用环境 主要以降低环境的侵蚀性和采取保护措施为主。
1)降低环境的侵蚀性,包括对酸度、温度、氧化剂和卤素离子的控制,其中要特别注意避免卤素离子向局部浓缩,尤其是氯离子。
2)提高溶液的流速或搅拌溶液,使溶液中的氧及氧化剂的浓度均匀化,避免溶液停滞不动,防止有害物质附着在构件表面上。
3)定期进行清洗,使构件表面保持洁净。
4)添加缓蚀剂。
5)采取阴极保护的电化学保护方法,如工程上采用铝、锌等作为牺牲阳极,对钢构件施加阴极保护,使钢构件的电位低于临界点蚀电位,可防止点腐蚀。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




