金属构件所用金属材料,基本上都是从自然界的矿石冶炼出来的。从热力学来看,这些材料都是不稳定的,倾向于和环境介质作用,转变成稳定的物质。在这一过程中,金属失去电子变成金属离子或金属化合物,而环境介质获得电子。这是一种自发的、自动进行的过程。根据金属与介质作用的方式划分,可以把这些过程的反应分为化学反应和电化学反应。某些时候,通过化学反应或电化学反应可以使金属材料的性能得到改善,但在更多情况下,化学反应或电化学反应会使金属材料的性能受到破坏,也即材料受到腐蚀。金属材料由于化学反应和电化学反应发生的失效分别称为化学腐蚀失效和电化学腐蚀失效。
1.化学反应
化学腐蚀的方式是环境介质中的某些组分在与金属表面接触时取得金属原子的价电子而被还原,与失去价电子的被氧化的金属形成腐蚀产物,一般情况下这种腐蚀产物覆盖在金属表面上。常见的化学腐蚀有干燥气体介质的腐蚀,如氧化、硫化、卤化和氢蚀等;液体介质的腐蚀,如非电解质溶液的腐蚀、液态金属的腐蚀、低熔点氧化物的腐蚀等。金属构件化学腐蚀失效中常见的是金属在高温气体中的氧化。下面以金属在干燥气体中的氧化为中心,简述化学腐蚀的基本原理和规律。
(1)氧化的基本原理
1)氧化发生的条件。以二价金属为例,氧化反应可以表示为
2M+O2→2MO (5-2)
式(5-2)反应达到平衡时体系中氧的分压称为金属氧化物的分解压(pMO)。pMO是在含氧环境中稳定性的参量。比较pMO和金属所处环境的氧的分压(pO2)的相对大小,可以判断金属是否具有氧化倾向。
当pO2=pMO时,金属与其氧化物处在平衡状态。
当pO2>pMO时,金属不稳定,具有氧化倾向生成金属氧化物。
当pO2<pMO时,金属稳定,金属氧化物具有还原倾向分解成金属。
常温下大气环境中氧的分压为0.022MPa。所以在常温中如果某一金属的pMO小于0.022MPa,该金属就可能氧化。pMO是温度的函数,一般随温度的上升而增加。
2)氧化膜的保护性。金属在常温大气环境下生成的自然氧化膜,厚度大致相当于数个分子,对金属的光泽没有影响,肉眼感觉不出。随着温度升高,氧化膜增厚,会呈现出不同的色彩,肉眼可以观察到氧化膜的存在。氧化膜的存在或多或少地阻隔了金属与介质之间的物质传递,不同程度地减缓了金属继续氧化的速度。氧化膜的保护性能与膜的结构关系密切,只有致密、完整的氧化膜才能把金属表面完全遮盖,从而有可能提供良好的保护作用。
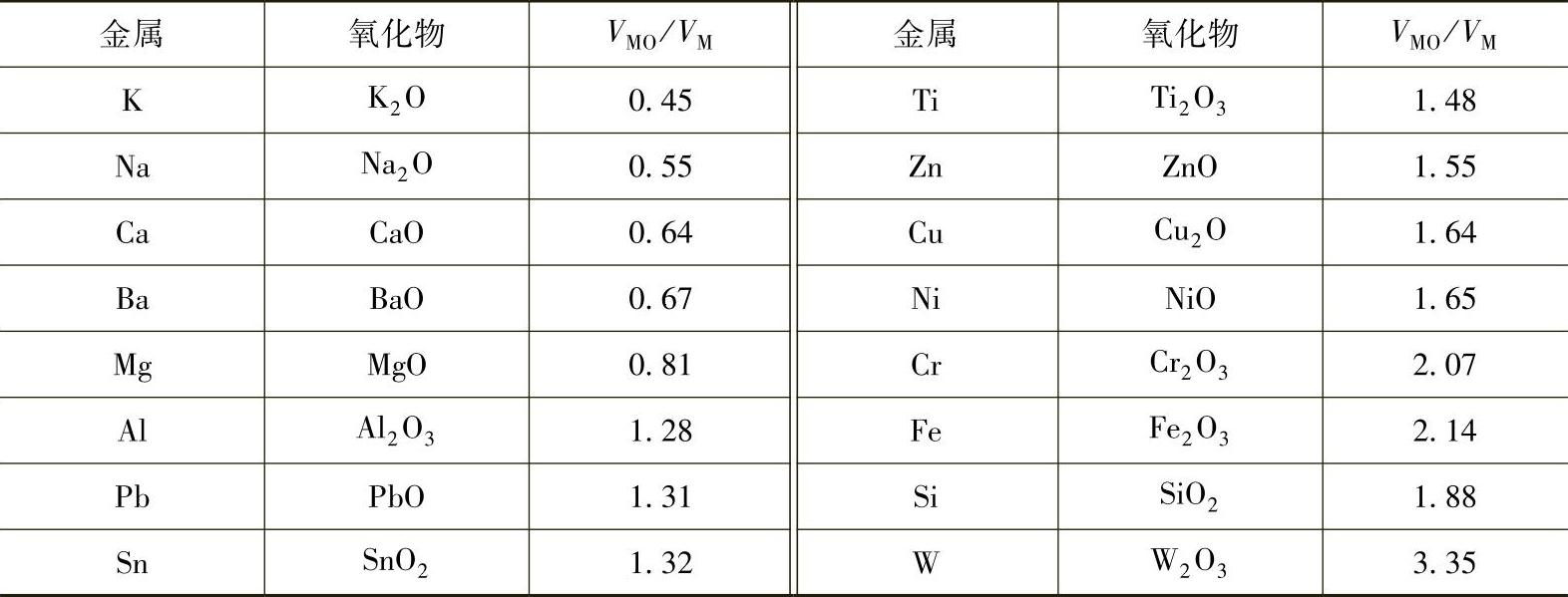
金属氧化膜完整的必要条件是金属氧化物的体积(VMO)大于生成此氧化物所消耗掉的金属体积(VM),也就是满足如下关系式。
VMO/VM>1 (5-3)
此比值不宜过大,因为VMO与VM的比值过大,形成氧化膜后内应力太大,膜容易破坏。一般认为,当2.5>VMO/VM>1时,更利于生成完整的氧化膜。部分金属的氧化膜与金属的体积比见表5-2。由表5-2可以看出,铝、铜、铁等金属材料VMO与VM的比值适中,有可能形成完整的氧化膜。
表5-2 部分金属的氧化膜与金属的体积比
除致密和完整以外,氧化膜还应满足以下条件,才能具有良好的保护作用:金属氧化物本身稳定、难熔、不挥发,不易与介质发生作用而被破坏;氧化膜与基体结合良好,有相近的热胀系数,不会自行或受外界作用而剥离脱落;氧化膜有足够的强度和塑性,足以经受一定的应力、应变的作用。
(2)氧化膜生长的规律 不同的金属,其氧化膜生长呈不同的规律,常见有以下几种规律。
1)直线规律。如果氧化膜对基体金属完全没有保护作用,氧化速度将直接由形成氧化物的化学反应速度决定,在温度恒定的条件下,反应速度也恒定。若以氧化时间作为自变量,以氧化膜质量或厚度为函数,将会得到一条直线。
y=Kt+C (5-4)式中,y为氧化膜质量或厚度;K为与温度有关的常数;C为常数;t为氧化时间。
反应温度不同,直线的斜率不同,温度越高,斜率越大,纯镁在不同温度下的氧化曲线如图5-42所示。除Mg以外,K、Na、Ca、W、Mo、V、Ta、Nb以及这些元素含量较高的合金的氧化都服从直线规律。
2)抛物线规律。当氧化膜对基体金属具有一定保护作用时,继续氧化的速度将与膜的质量或厚度成反比,呈抛物线关系。
y2=Kt+C (5-5)式中,y为氧化膜质量或厚度;K为与速度有关的常数;C为积分常数;t为氧化时间。
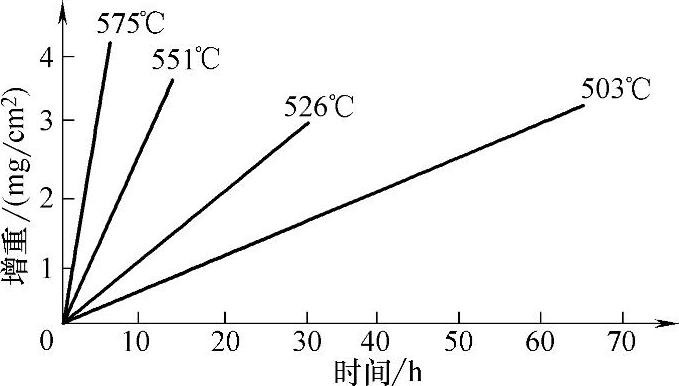
图5-42 纯镁在不同温度下的氧化曲线
在一定温度下,很多金属和合金,如Fe、Co、Ni、Cu等金属的氧化物都呈现这种抛物线成长规律,而在氧化开始阶段,膜的生长服从直线规律。铁在高温空气中的氧化曲线如图5-43所示。
3)对数规律。某些金属的氧化膜在生长过程因体积效应内应力增大,膜的外层变得更加紧密,使氧离子或金属离子的扩散更加困难,进一步氧化的速度比抛物线规律更慢,膜的质量或厚度与时间的关系服从对数规律。
y=ln(Kt)+C (5-6)式中,y为氧化膜质量或厚度;K为与速度有关的常数;C为积分常数;t为氧化时间。
Cr和Zn在25~225℃范围内,Ni在650℃以下,Fe在375℃以下,膜的生长都服从对数规律。铁在242℃和305℃时的氧化曲线如图5-44所示,从图中可观察到这一规律。与抛物线规律一样,在膜刚开始生长阶段,膜层厚度接近零时,膜的生长速度只受化学反应速度控制,服从直线规律。
上述三种规律是最常见的。此外还有立方规律、反对数规律等,它们可以看成是抛物线规律和对数规律的引申。
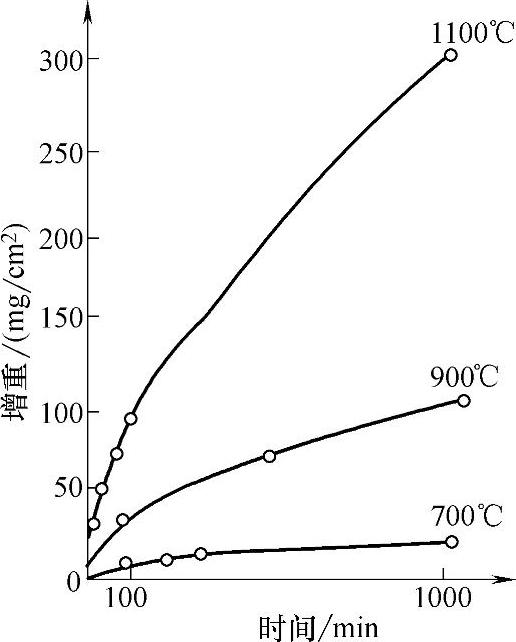
图5-43 铁在高温空气中的氧化曲线
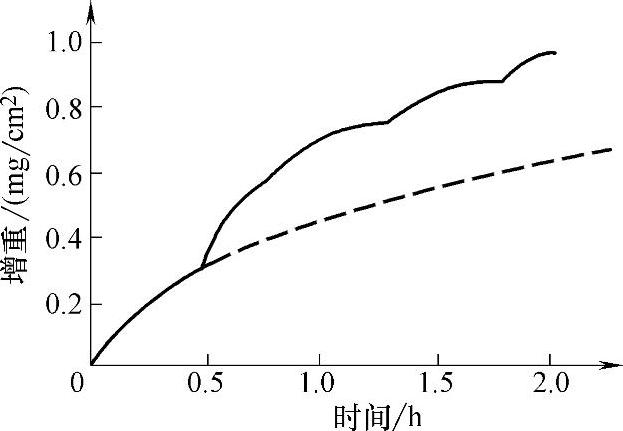
在进行氧化速度测定时需要注意的是,由于氧化物的体积大于其所消耗掉的金属的体积,随着膜的生长,膜内产生的内应力也增大,以致氧化膜可能破裂,导致金属氧化加速。图5-45所示为铜在500℃的氧化曲线,它由几段曲线组成,表明膜在生长过程曾因内应力作用几次破裂。每段曲线均由初始的直线段和随后的抛物线段组成,总试验过程的氧化速度接近直线规律。虚线为膜不发生破裂时应遵循的曲线,对氧化曲线的分析,必须考虑膜层破裂所造成的影响。
环境温度对金属氧化曲线有两方面的影响。一方面,温度影响金属的氧化速度。大多数金属氧化速度随着温度升高而急剧增大。另一方面的影响是可能改变氧化反应的规律。图5-44和图5-45表明铁和铜在不同温度下,氧化膜生长的规律不同。
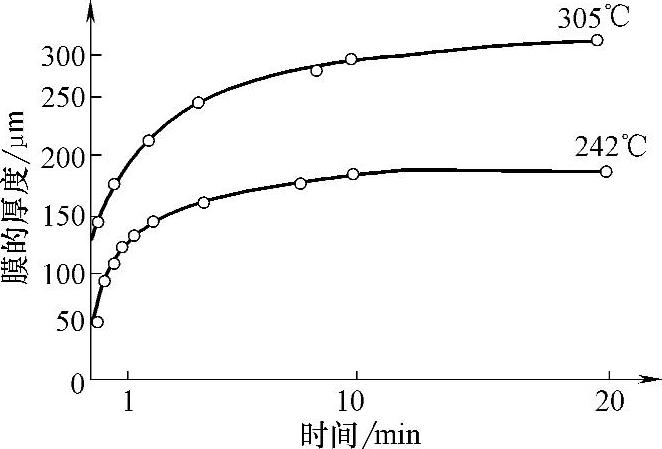
图5-44 铁在242℃和305℃时的氧化曲线
 (https://www.xing528.com)
(https://www.xing528.com)
图5-45 铜在500℃的氧化曲线
(3)钢铁的高温氧化腐蚀 钢铁是机械装备金属构件中应用最广泛的金属材料。在常温干燥空气中,钢铁氧化速度较慢。温度升至200~300℃,钢铁表面出现可见的氧化膜。随温度升高膜逐渐增厚。
钢铁氧化膜的结构比较复杂。在570℃以下,仅生成Fe3O4和Fe2O3,它们的结构致密,保护作用较好,因此氧化速度比较低;温度超过570℃时,在氧化膜的内层生成FeO。FeO的结构疏松,晶格缺陷密度高,金属离子和氧离子容易扩散穿过,氧化速度急剧增大。当温度高于800℃时,表面上开始形成多孔、疏松的氧化皮。氧化皮与基体结合松散,稍受振动便以层状脱落。气相的组成,对钢铁的高温腐蚀有强烈的影响。特别是水蒸气和硫的化合物的影响最大。
2.电化学反应
当环境介质含离子导体时,金属与介质的作用将以另一种方式进行。这时金属失去电子(广义也称为氧化)和介质获得电子这两个过程在金属表面的不同部位同时进行,并且得失电子的数量相等。金属被氧化后成为正价离子(包括络合离子)进入介质或成为难溶化合物(一般是金属的氧化物或含水氧化物或金属盐)留在金属表面。金属失去的电子通过金属材料本身流向金属表面的另一部位,在那里由介质中被还原的物质所接受。按这种途径进行的反应称为电化学反应,或称为电化学腐蚀。金属在酸、碱、盐溶液中,在土壤、潮湿的大气等多个环境中发生的腐蚀都是电化学腐蚀。电化学腐蚀是最普遍的腐蚀现象。
(1)电化学腐蚀模型
1)腐蚀原电池模型。将金属锌浸入硫酸溶液中,可以观察到锌逐渐溶解,同时有氢气自金属锌的表面析出,如图5-46所示。
金属锌溶解就是锌以离子的形式进入溶液,同时放出电子。
Zn→Zn2++2e (5-7)
由于溶液中的氢离子夺取了金属上的多余电子,成为氢原子,进而复合为氢气。
2H++2e→H2↑ (5-8)
式(5-7)和式(5-8)都是在金属锌上进行的反应,均称为电极反应。式(5-7)是失去电子的反应,称为氧化反应,在电化学腐蚀中也称为阳极反应。式(5-8)是得到电子的反应,称为还原反应,在电化学腐蚀中也称为阴极反应。在式(5-8)中进行还原反应的物质是H+,称为氧化剂。阳极反应和阴极反应统称为电化学反应。式(5-7)和式(5-8)两个反应虽然都在金属锌表面进行,但就某一时刻来说,它们是在不同部位同时独立进行的,而不是金属锌和氢离子直接接触发生电子交换。发生阳极反应的区域称为阳极区,发生阴极反应的区域称为阴极区。
还原反应同时在锌电极表面的阳极区和阴极区进行,反应产生的电子流只在锌电极内部流动,不能对外做功,是短路的原电池。这种引起金属腐蚀的短路原电池称为腐蚀原电池。
2)腐蚀原电池的类型。腐蚀电极表面不同部位分别形成阳极区和阴极区,其原因是电极表面的电化学不均匀性。这种不均匀性来自金属材料和环境介质两个方面。在金属材料方面,存在化学成分、组织结构、表面膜完整性、受力情况等差异;在环境介质方面,有成分、浓度、温度、充气等不同情况。依照阳极区和阴极区的大小,腐蚀原电池可以分为宏观腐蚀原电池和微观腐蚀原电池两大类。
宏观腐蚀原电池是肉眼可以观察到的,主要有三种类型:异种金属接触所构成的电偶电池;金属处在浓度不同的介质(包括所充气体)中所形成的浓差电池;金属处在温度不同的介质中所形成的温差电池。
微观腐蚀原电池是肉眼不可分辨的,其形成原因可以分为四种类型:材料化学成分不均匀,微观组织不均匀,受力不均匀,表面膜不完整。
金属材料的电化学不均匀性是腐蚀原电池产生的内因,但腐蚀原电池的形成,还需要环境介质中存在氧化剂,只有氧化剂进行得电子的还原反应,才能使金属失电子的氧化反应持续进行。对于电化学腐蚀体系,氧化反应和还原反应是一对互为依存的共轭反应。从这个角度上讲,氧化剂的存在,是金属发生电化学腐蚀的必需的条件。
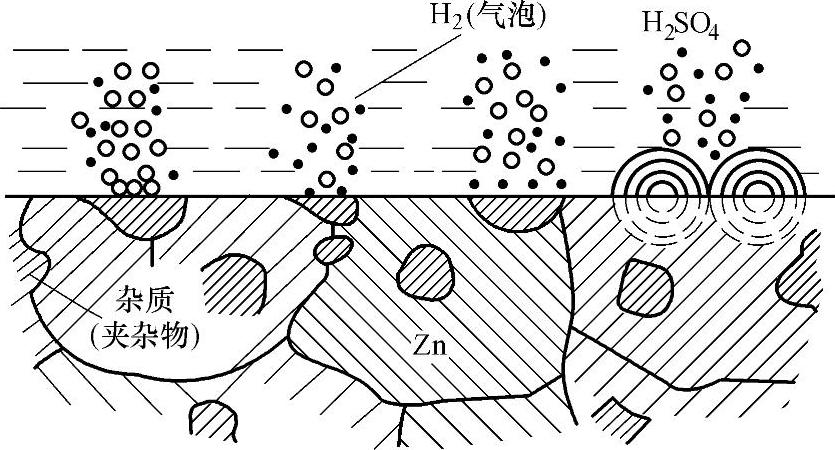
图5-46 锌在硫酸溶液中溶解示意图
(2)电化学腐蚀的氧化剂 硫酸溶液中的氢离子可以作为氧化剂消耗锌溶解所放出的电子,但当锌电极放在同一溶液中,氢离子却不能夺取锌的电子,即不能作为氧化剂而起作用。为什么这两个电极系统有截然不同的行为?为了解释这个问题,需要对电极电位等概念做简单介绍。
1)电极电位。当把电子导体的金属材料放在离子导体的电解质如水溶液中,金属表面的金属正离子一方面受金属内部的金属离子和电子的作用,另一方面与溶液相邻处又受极性水分子或水化离子的作用。两方面的力作用的结果,会产生两种情况:当前一个力小于后一个力时,金属表面将会有部分金属离子从金属转入溶液,而把电子留在金属上,这时金属带多余的负电荷,溶液一侧则因金属离子的转入而带正电荷;反之,当前一个力大于后一个力时,将有金属阳离子或其他水化阳离子从溶液侧转到金属上,使金属带多余的正电荷,溶液侧则带负电荷。电极与溶液界面带等量的异种电荷的结构称为双电层。双电层类似一个充了电的电容器,其两端的电位差就是金属在该电解质中的电极电位。
如果只是同一种物质的电荷在金属和溶液之间转移,经过一段时间,双向转移将会等速,也即单位时间内有多少荷电物质从金属电极转入溶液,也就有等量的同种荷电物质从溶液转入金属电极,电极反应达到平衡,这种类型的电极称为平衡电极,对应的电极电位称为平衡电极电位。电极反应达到平衡时可分别表示为
Zn2++2e→Zn (5-9)
2H++2e→H2 (5-10)
不同的电极反应,其平衡电极电位不同。同一反应的平衡电极电位也随温度、溶液浓度及气体溶解量变化而变化。温度在25℃,溶液中各物质的活度为1mol/L(若为气体,逸度1.03MPa)时的电极电位称为该电极的标准电极电位。这里规定,式(5-10)所表示的反应在铂电极上进行时的标准电极电位为零(各种电极反应的标准电极电位可从化学和物理化学教科书的附录查找)。
金属及其离子构成的平衡电极电位越正,氧化的倾向就越小。如果某金属的平衡电极电位比该溶液中氢离子反应的平衡电极电位正,氢离子就不可能夺取电子成为氧化剂。反之,金属的平衡电极电位越负,氧化的倾向就越大。如果某金属的平衡电极电位比该溶液中氢离子反应的平衡电极电位负,氢离子就可能成为该金属腐蚀反应的氧化剂。
2)氢离子腐蚀和氧腐蚀。除氢离子可在电极上进行反应外,在电化学腐蚀中还有两个值得注意的电极反应。
在酸性溶液中:
O2+4H++4e→2H2O (5-11)
在碱性溶液中:
O2+2H2O+4e→4OH- (5-12)
这两个电极反应的标准电极电位分别为1.229V和0.401V,比氢标准电极电位正很多。也就是说,在标准状态下,O2比H+更具氧化能力。例如,铜的标准电极电位为0.3419V,在除氧的稀硫酸溶液中,H+不能成为铜的氧化剂,铜不发生腐蚀。但当稀硫酸溶液含氧时,铜电极的某些部位有式(5-11)向右方向进行的反应,O2消耗电子,还原成H2O。这时O2成为腐蚀原电池的氧化剂,使铜电极受腐蚀。
溶液中的其他物质或离子,只要具有得电子的能力,氧化态和还原态之间电极反应的平衡电位正于金属及其离子构成的平衡电极电位,都有可能成为金属腐蚀的氧化剂。但大多数腐蚀的阴极过程都是O2和H+的还原。
(3)电化学腐蚀的速度 按腐蚀原电池模型,电化学腐蚀的速度可由电池的工作电流确定。根据欧姆定律,用电池电动势除以内外电路的总电阻可以得到原电池的工作电流。电池电动势可由原电池阴极和阳极反应的电极电位差求出。电池电动势越大,体系的腐蚀电流也应越大。
但实际测量结果与计算结果不相符:实测值比计算值往往低一、两个数量级;有些电动势大的体系,腐蚀速度反而低。产生这种现象的原因是当电极上有电流流动时,电极的平衡状态被打破,阳极区的电极反应向氧化态方向进行,而阴极区的电极反应向还原态方向进行。反应的结果使双电层上电荷的分布发生变化,原电池阳极的电位变正,阴极的电位变负,电池工作电位将远低于电池电动势。电极电位在有电流时发生偏移的这种现象称为极化。极化使腐蚀电流变小。电化学腐蚀速度不能由电池电动势的大小判断,需要通过实验,研究电极的极化行为才能确定。
在讨论电化学腐蚀速度时,还有一种现象需要加以注意,这就是金属的钝化。钝化是指金属在某些介质中失去化学活性。钝化的原因有可能是表面形成吸附层,也有可能是氧化时,金属不是以离子状态进入溶液,而是生成氧化物,形成对基体金属的保护膜,使腐蚀速度下降。有两种类型的钝化,一种是化学钝化,也称为自动钝化,这是金属与钝化剂自然作用产生的。例如,钢在稀硫酸中是溶解的,并且随稀硫酸的浓度增加腐蚀速度加快。但当硫酸浓度增大到80%时,腐蚀速度陡然下降,达几个数量级之多,这就是化学钝化。另一种钝化称为电化学钝化,它是通过对金属施加阳极电流而形成的钝化。一般情况下,施加阳极电流会使腐蚀加速,但在某些介质中却有相反的结果。例如,在稀硫酸中可以通过施加阳极电流的方法,使腐蚀电流下降几个数量级。钝化现象比较广泛,因此研究并利用钝化现象对控制腐蚀和延长设备寿命有重要的意义。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




