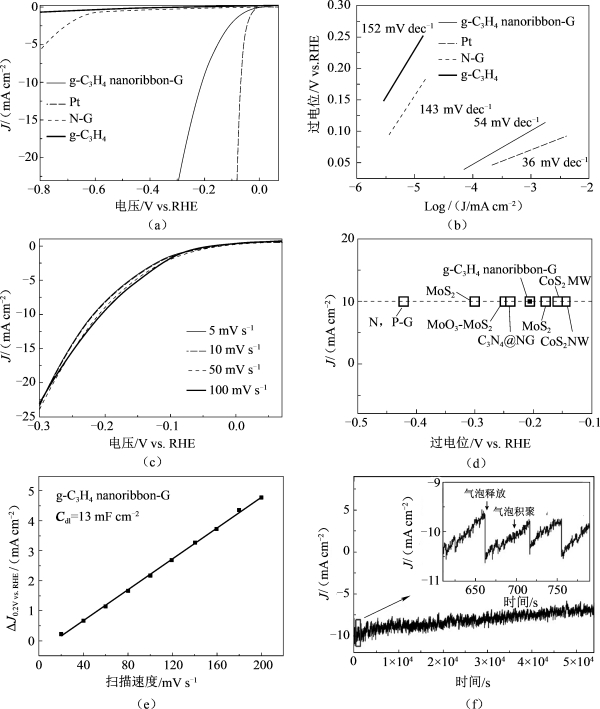
我们采用三电极体系对g-C3N4 nanoribbon-G进行HER性能测试,所选取的电解液为0.5 mol·L−1 H2SO4溶液,样品的负载量为0.143 mg·cm−2。这里选取N-G(氮原子含量为8%)和初始的g-C3N4作为对比样品进行测试。如图7.4(a)所示,g-C3N4 nanoribbon-G表现出了比其他碳基材的催化剂甚至非贵金属或者金属氧化物催化剂更小的初始过电位(η=80 mV)[4,5,21,22]。另外,在η=300 mV的情况下,g-C3N4 nanoribbon-G显示出了23.7 mA·cm-2的阴极电流密度,是N-G电流密度(0.24 mA·cm-2)的100倍并且远远大于初始g-C3N4的电流密度(0.04 mA·cm−2)。g-C3N4 nanoribbon-G的Tafel曲线的斜率为54 mV·dec-1(图7.4(a)(b)),表明在增加过电位的同时进一步加快了HER的反应速率。如图7.4(c)所示,在不同的扫速下,g-C3N4 nanoribbon-G的电流-电压(I-V)曲线几乎一样,说明扫速对HER的影响很小。同时,g-C3N4 nanoribbon-G能够在比其他非金属催化剂更小的过电位(-207 mV)下达到10 mA·cm-2(图7.4(d)),甚至与那些金属的衍生物催化剂相媲美[13,21,22]。此外,通过延长g-C3N4 nanoribbon-G的Tafel曲线所得到的交换电流密度(J0)为39.8μF·cm-2。这个交换电流密度是归一化到质量和面积的,而且远远大于那些非金属、非贵金属纳米材料及其衍生物[4,13,21-23]。
为了研究g-C3N4 nanoribbon-G液-固界面的活性比表面积,通过简单的CV曲线测试了其双电层电容(Cdl,图7.4(e))[13,24]。在电容测试过程中,选取0.15~0.25 V vs.RHE作为电压测试窗口,在该电压范围内法拉第电流几乎是可以忽略的。g-C3N4 nanoribbon-G表现出了较高的Cdl(13 mF·cm-2),说明了其内部较高的活性位点和出色的HER性能。此外,在过电位为200 mV的恒电位下,还对其进行了稳定性测试。如图7.4(f)所示,由于电极表面的H2气泡不断地产生和释放,促使g-C3N4 nanoribbon-G的曲线呈现锯齿状。经过54 000 s的测试之后,其电流密度显示出了微小的降低,这可能是由H+的消耗及H2在电极表面的积累造成的。
通常在酸性下,HER的反应机理包括两个步骤实现H+向H2的转换[4,25]。第一个步骤是H原子在电极表面的吸附和还原过程,称之为沃尔默反应式(Volmer reaction):H3O++e-+*→H*+H2O,其中H*表示催化剂与H结合的活性位点。第二个步骤是H2的释放过程,该过程有两种方式:一种为海洛夫斯基反应式(Heyrovsky reaction):H*+H3O++e-→H2+H2O+*;另一种为Tafel反应式:H*+H*→H2+2*。
 (https://www.xing528.com)
(https://www.xing528.com)
图7.4 g-C3N4 nanoribbon-G及其对比样品的电催化析氢性能测试
不同催化剂(g-C3N4 nanoribbon-G、Pt丝、N-G和g-C3N4)在0.5 mol·L-1 H2SO4溶液中的HER的极化曲线(a)和相应的Tafel曲线(b),扫速为50 mV·s-1;(c)g-C3N4 nanoribbon-G在扫速为5~100 mV·s-1下的电流极化曲线;(d)当HER电流密度达到10 mA·cm-2时,不同催化剂所产生的过电位;(e)g-C3N4 nanoribbon-G在0.2 V的双电层电容(Cdl);(f)在相对RHE为200 mV的过电位下的时间-电流曲线
g-C3N4 nanoribbon-G出色的HER性能和稳定性主要总结为以下三个方面:①具有独特1D结构的g-C3N4 nanoribbon不仅能够提供较高的与H结合的活性位点[13],而且这种结构能够加快其内部电子沿着1D轴向的传输。②原位将1D g-C3N4 nanoribbon组装到3D石墨烯网络结构中能够加强g-C3N4和石墨烯的物理接触以及电子的传递,从而加快了电子从石墨烯片层到g-C3N4的流动。③所制备的1D g-C3N4 nanoribbon凌乱地分布在石墨烯表面,并在其表面形成了类似“网格”的结构。这种结构能够实现催化剂与电解液的充分接触并加快H2从电极表面的脱附,从而防止气泡在表面聚集对样品结构进行破坏,表现出了较强的稳定性。总之,这种独特的分级结构材料是一种新型、高效的HER非金属催化剂。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




