无机纳米颗粒在工程设计上的灵活性使其可以按照需要设计形状、大小、表面配体,从而为发展集成药物递送系统提高肿瘤治疗效率提供可能。传统无机纳米颗粒经过数十年的实验研究证实其在精准控释药物时仍存在设计瓶颈,阻碍了基于无机载体肿瘤治疗的临床应用。
研究人员发现,基于液态镓铟合金(GaIn25)发展的纳米药物递送系统可以克服这一瓶颈[19]。这种新型纳米药物具有制作简单方面的优点,在温和的酸性环境,显示出自主融合能力。GaIn25合金在常温下是低黏度液体,与汞金属不同的是,它具有较低的毒性,因此在微流体、柔性机器人应用中受到重视。为获取GaIn25纳米药物载体,可在常温下将GaIn25合金与两种高分子聚合物巯基(2-羟丙基)-β-环糊精(MUA-CD)及巯基化透明质酸(m-HA)混合并予以超声处理,最后获取的纳米药物载体(LM-NPs/L)包括三个功能成分:一个载药连接体(MUA-CD)、靶向配体(m-HA)和液态金属核心(GaIn25)(图15.25a)。其中,七元糖环的MUA-CD提供了广谱化疗药物阿霉素(DOX)稳定加载位点,m-HA支持主动靶向受体包括CD44受体,其高表达于多种肿瘤细胞表面,包括宫颈癌和乳腺癌。而液态金属在被细胞内吞后,则发生相互融合,在肿瘤内酸性微环境下,导致阿霉素的配体解离和促进药物的释放(图15.25a)。
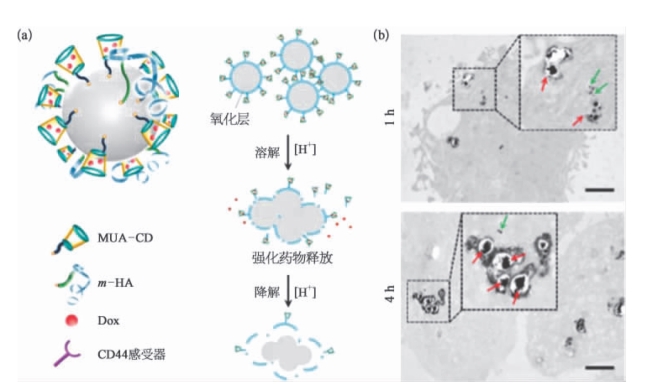
图15.25 纳米液态金属颗粒细胞融合示意[19](https://www.xing528.com)
a.纳米液态金属的组成;b.TEM图像显示纳米液态金属药物在细胞内的融合现象。
为进一步观察纳米药物细胞内融合效应,研究人员将其与宫颈癌细胞HeLa细胞孵育,通过透射电镜进行可视化观察。实验发现,培养1h后,在酸性内涵体中可清楚地观察到液态金属纳米颗粒的融合;培养4h后,更多的融合现象被检测到。元素表面散射分析结果显示,Ga的散射信号在细胞内孵育5 min后由于表面氧化即收到干扰。在细胞中培养1h后,元素硫及氧信号的增强表明硫基表明配体的解离,由此进一步证实纳米药物在细胞内的初始融合现象。
以上实验证实,基于纳米液态金属的融合变形可以在肿瘤细胞内实现精准的药物释放。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




