液态金属由于具有柔顺性,可以像水一样被针头吸入和排出。未来的液态金属电极,尤其是植入电极可以避免外科手术所带来的感染,副作用等的风险,而仅用针头的注入,当然,也可以是多点液态金属电极的微创注入的形式,应用在深部脑刺激,深部电疗等方面。液态金属可注射电极的微创治疗不仅方便、副作用少,而且移出电极容易(仅需要用针头析出),是未来生物电极材料的重要研究方向。
Jin等[6]建立了一种基于液态金属的可植入式生物医学电子器件体内3D打印成型技术。在此项研究中,科研人员首次提出了一种以微创方式直接在生物体内目标组织处喷墨注射成型的医疗电子器件在体制造方法(图15.7),并通过系列实验证明了新方法的高效性。这种方法的原理在于[6]:将生物相容的封装材料注射于体内固化形成特定结构(图15.8),在此区域内进一步将导电性金属墨水、绝缘型墨水乃至配套的微/纳尺度器件等顺次注射后形成目标电子装置,通过控制微注射器的进针方向、注射部位、注射量、针头移位及速度这样的3D打印步骤,可在目标组织处按预定形状及功能构建出终端器械(图15.9)。由于全部器件及单元均采用基于微针的液相注射方式实现,因而整个手术过程达到了高度的微创性,动物实验证实了相应的技术思想(图15.10)。若进一步采用手术机器人,还可将此步骤大大简化并提升自动化程度。新方法为生物医用柔性电子植入技术开辟了一条全新途径。
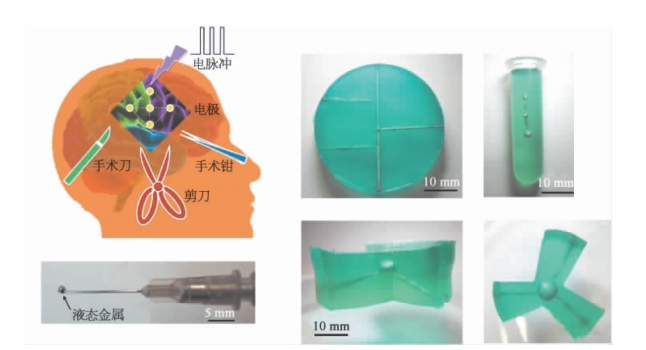
图15.7 可注射式医疗器械体内3D打印成型技术及所实现的空间电极[6]
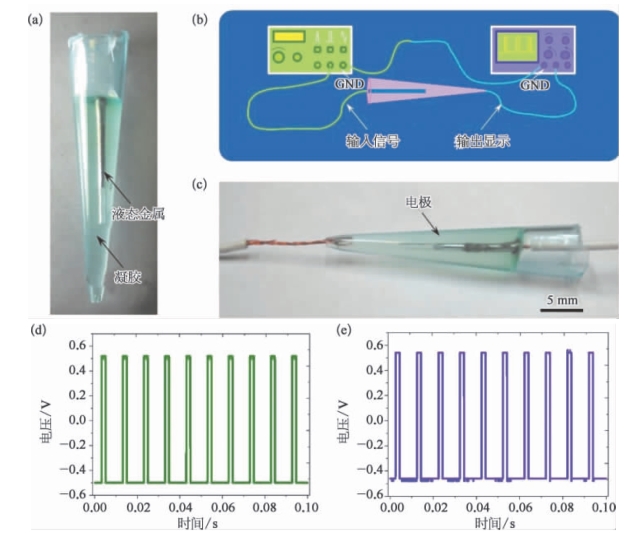
图15.8 封装于固化成型的透明介质中的液态金属电极及其性能实验[6]
a.1 mL移液管尖端中形成的电极;b、c.电极的电子试验;d.试验结果;e.输入信号。(https://www.xing528.com)
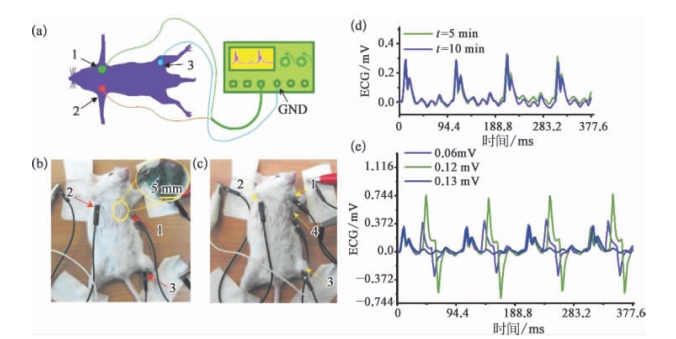
图15.9 借助于注入体内的液态金属电极实现小鼠ECG信号高信噪比测量及电学刺激[6]
a—c.使用注入电极测量小鼠ECG信号;d—e.记录下的ECG信号。
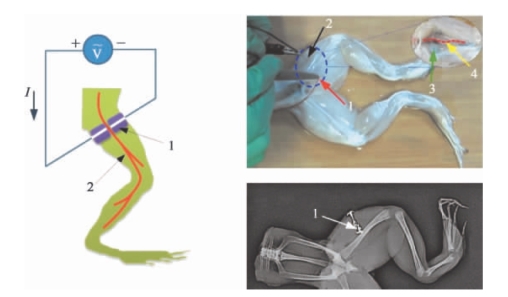
图15.10 基于注射的液态金属电极对牛蛙腿中坐骨神经进行刺激[6]
临床上常用的植入式医疗器械,如脑起搏器、心脏起搏器、神经刺激器等,为广大脑中风、心血管疾病与糖尿病患者的生理功能保障提供了不可或缺的支撑,但其缺点也十分鲜明。比如,此类设备植入过程手术繁琐、创伤大,患者常常要接受开颅、开胸手术、设备植入、伤口缝合等一系列复杂程序。这样一方面会给患者造成身心痛苦,创口过大还易于引起手术并发症及感染风险,同时手术与设备运行支持等无形中也给患者带来物质上的压力。此外,传统的刚性设备植入体内后会不时带给应用对象不舒适感。为此,若能实现一种方便快捷的体内柔性电子装置直接打印制造方法,则将在大大缓解患者负担的同时也有助于推进灵巧型植入式医疗电子技术的进步。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




