金属中由于原子间通过较强的金属键结合,因而金属原子趋于紧密排列,构成少数几种高对称性的简单晶体结构。在金属元素中,约有90%以上的金属晶体结构都属于如下三种紧密排列的晶格形式。
1)体心立方晶格
体心立方晶格的晶胞是一个立方体,如图2-4所示,在立方体的八个角上各有一个与相邻晶胞共有的原子,并在立方体中心有一个原子。因其晶格常数a=b=c,故通常只用一个常数a即可表示。这种晶胞在其立方体对角线方向上的原子是彼此紧密相接触排列着的。立方体对角线的长度为 ,等于四个原子半径,故体心立方晶胞中的原子半径r=
,等于四个原子半径,故体心立方晶胞中的原子半径r=![]() 在此晶胞中,因每个顶点上的原子是同时属于周围八个晶胞所共有,故实际上每个体心立方晶胞中仅包含着:
在此晶胞中,因每个顶点上的原子是同时属于周围八个晶胞所共有,故实际上每个体心立方晶胞中仅包含着:![]() 个原子。每个原子的最邻近原子数为8,所以配位数为8。因
个原子。每个原子的最邻近原子数为8,所以配位数为8。因![]() 故可求得致密度K为0.68。此值表明,在体心立方结构的金属中,有68%的体积被原子所占据,其余32%的体积则为空隙。
故可求得致密度K为0.68。此值表明,在体心立方结构的金属中,有68%的体积被原子所占据,其余32%的体积则为空隙。
属于体心立方晶格的金属有α-Fe、Cr、Mo、W、V、Nb、β-Ti、Na、K等。

图2-4 体心立方晶胞示意图
2)面心立方晶格
面心立方晶格的晶胞如图2-5所示,在立方体的八个角的顶点和六个面的中心各有一个与相邻晶胞共有的原子。在这种晶胞中,每个面的对角线上各原子彼此相互接触,因而其原子半径![]() 又因每一面心位置上的原子是同时属于两个晶胞所共有的,故每个面心立方晶胞中包含有:
又因每一面心位置上的原子是同时属于两个晶胞所共有的,故每个面心立方晶胞中包含有: ×6=4个原子。可求出面心立方晶格的配位数为12,致密度为0.74。
×6=4个原子。可求出面心立方晶格的配位数为12,致密度为0.74。
属于面心立方晶格的金属有γ-Fe、Cu、Al、Ni、Au、Ag、Pt、β-Co等。
 (https://www.xing528.com)
(https://www.xing528.com)
图2-5 面心立方晶胞示意图
3)密排六方晶格
密排六方晶格的晶胞是一个正六面柱体,如图2-6所示。由图可见,在上下两个面的角顶点和中心上,各有一个与相邻晶胞共有的原子,并在上下两个面的中间有三个原子。晶格常数用六方晶胞底面的边长a和上下底面间距c表示,在上述紧密排列情况下,c/a≈1.633。最近邻原子间距为a,其原子半径 每个角上的原子同时为六个晶胞所共有,上下底面中心的原子同时为两个晶胞所共有,再加上晶胞内的三个原子,故密排六方晶胞的原子数为:
每个角上的原子同时为六个晶胞所共有,上下底面中心的原子同时为两个晶胞所共有,再加上晶胞内的三个原子,故密排六方晶胞的原子数为:![]() ×2+3=6个。同样可得出其配位数为12,致密度为0.74。
×2+3=6个。同样可得出其配位数为12,致密度为0.74。
属于密排六方晶格的金属有Be、Mg、Zn、Cd、α-Co、α-Ti等。

图2-6 密排六方晶胞示意图
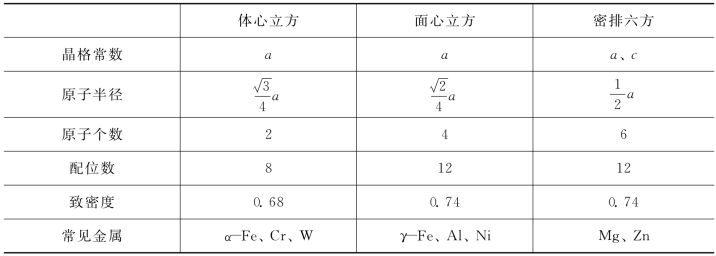
三种晶体结构特征参数见表2-1,由表可见:面心立方晶格和密排六方晶格中原子排列紧密程度完全一样,在空间是最紧密排列的两种形式。体心立方晶格中原子排列紧密程度要差些。因此当一种金属(如Fe)从面心立方晶格向体心立方晶格转变时,将伴随着体积的膨胀。
表2-1 常见金属的晶体结构
由于晶体中不同晶向上的原子排列紧密程度及不同晶面的面间距是不相同的,所以不同方向上原子结合力也不同,从而导致晶体在不同方向上的物理、化学、力学性能出现一定的差异,此特性称为晶体的各向异性。例如单晶体α-Fe的弹性模量,在体对角线[111]方向上为2.90×105 MPa,而在沿立方体边长[100]方向上只有1.35×105 MPa。晶体性能的方向性,在以后研究金属塑性变形时,将是一个重要理论基础。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




